автордың кітабын онлайн тегін оқу Биохимия метаболизма
Биохимия метаболизма
Учебное пособие
Е. А. Бессолицына
© Е. А. Бессолицына, 2016
ISBN 978-5-4483-3663-8
Создано в интеллектуальной издательской системе Ridero
Введение
Биохимия – это наука о структуре молекул, входящих в состав живых организмов, а также о механизмах их превращений внутри организма или клетки.
Термин «биохимия» эпизодически употреблялся с середины XIX века, в классическом смысле он был предложен и введён в научную среду в 1903 году немецким химиком Карлом Нейбергом.
Биохимия является продолжением органической химии. Собственно многие молекулы (спирты, гетероциклы и другие) являются объектами исследований специалистами в области органической химии.
Биохимия изучает структуру, свойства и функции молекул, входящих в состав живых организмов. Эту часть биохимии изучает раздел, который получил название «Структурная биохимия». Кроме этого существует второй раздел, получивший название «Биохимия метаболизма». Все молекулы, которые входят в состав клеток и организмов превращаются друг в друга в ходе множества химических реакций. Именно поэтому клетка – это сложнейшая химическая система, состоящая из множества молекул, которые постоянно вступают в различные реакции, в результате образуются другие биологические молекулы. Совокупность всех этих реакций получила название метаболизм. Все реакции метаболизма подразделяют на две большие группы: катаболизм и анаболизм.
Реакции катаболизма – это реакции энергетического обмена, то есть химических превращений органических молекул в энергию АТФ. АТФ или аденозинтрифосфат является основным источником энергии для транспортных, механических и других клеточных процессов. Реакции энергетического обмена направлены на синтез молекул АТФ.
Реакции анаболизма – это реакции пластического обмена, направленные на синтез молекул, из которых собираются компоненты клетки, в результате она растет и размножается. Часто одна молекула превращается в другую не результате одной реакции, в результате их последовательности. Эти последовательности реакций называют метаболитическими путями.
Данный учебник называется «Биохимия метаболизма». В нем рассматриваются последовательности реакций основных метаболитических путей пластического и энергетического обменов, а также механизмы регуляции скорости этих метаболитических путей.
Термодинамика биохимических реакции
Клетка состоит из множества различных молекул, часть из них обнаруживается у всех живых организмов, тогда как другая часть уникальна для клетки и/или отдельного организма. Соответственно, необходимо эти вещества синтезировать. В каждой клетке в одну единицу времени происходит множество химических реакций. Совокупность всех реакций клетки получило название – метаболизм. В каком-то приближении клетку можно сравнить с реактором, в которой происходит множество реакций, из чего можно считать клетку химической системой. Для описания таких систем и сформулированы законы термодинамики.
Первый закон термодинамики гласит: внутренняя энергия системы вместе с ее окружением остается постоянной.Это одна из формулировок закона сохранения энергии, согласно которой можно утверждать, что при любых изменениях системы внутренняя энергия не утрачивается и не приобретается. Вместе с тем внутри рассматриваемой системы энергия может переходить от одной ее части к другой или превращаться из одной формы в другую. Например, химическая энергия может переходить в тепло, превращаться в электрическую энергию, энергию излучения или в механическую энергию.
Второй закон термодинамики гласит: энтропия системы при самопроизвольных процессах возрастает.
Энтропияслужит мерой неупорядоченности, хаотичности системы и достигает максимума, когда система приходит в истинное равновесие. При постоянных температуре и давлении соотношение между изменением свободной энергии системы (ΔG) и изменением энтропии (ΔS) представляется следующим выражением, которое объединяет оба закона термодинамики:
ΔG= ΔH-Т ΔS.
где ΔG – изменение свободной энергии системы, то есть та часть изменения внутренней энергии системы, которая может превращаться в работу, ΔН – изменение энтальпии(теплоты), Т – абсолютная температура.
В условиях, при которых протекают биохимические реакции, ΔН приблизительно равно ΔЕ-изменению внутренней энергии системы в результате реакции. В этих условиях приведенное выше выражение можно записать в виде:
ΔG= ΔЕ-Т ΔS
Если ΔG отрицательно, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими.Если к тому же ΔG велико по абсолютной величине, то реакция идет практически до конца и ее можно рассматривать как необратимую. Если же ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такая реакция называется эндергонической.Если к тому же ΔG велико, то система является устойчивой и реакция в этом случае практически не осуществляется.
При ΔGравном нулюсистема находится в равновесии. Причем ферменты не влияют на ΔG реакции ΔG=-RTlnKeq. Таким образом сдвинуть равновесие можно либо сообщая системе дополнительную энергию (проще всего нагреванием) либо увеличивая концентрацию реагентов. Реакция может протекать спонтанно только при отрицательном значении изменения свободной энергии (ΔG). ΔG не зависит от пути, по которому идет реакция, и зависит только от природы реагирующих веществ и их активности (которую можно иногда примерно определять по их концентрации).
Изменение свободной энергии реакции в условиях, когда активность реагирующих веществ и образующихся продуктов равна единице, называется изменением стандартной свободной энергии (ΔG0). Измеряют изменение свободной энергии в стандартных условиях, то есть при давлении 1 атмосфера, 2980 Кельвина (или 250 С), а так же концентрации реагирующих веществ одинаковы и равны 1М. В биологических системах данные параметры не соблюдаются, особенно относительно концентраций реагирующих веществ, в природе концентрация реагирующих веществ никогда и не соответствует стандартным, именно поэтому в биохимии используется понятие ΔG0, которое соответствует понятию свободной энергии в физической химии.
Если рассмотреть реакцию А + В ↔ C + D.
ΔG этой реакции дается уравнением
ΔG = ΔG0 + RTln ([C] [D] / [A] [B])
где ΔG°– изменение стандартной свободной энергии, R-газовая постоянная, Т-абсолютная температура, [А], [В], [С] и [D] -молярные концентрации (точнее активности) реагирующих веществ. ΔG0-изменение свободной энергии реакции при стандартных условиях, когда каждое из реагирующих веществ А, В, С и D присутствует в концентрации 1,0 М. Таким образом, ΔG реакции зависит от природы реагирующих веществ.
Можно легко вывести соотношение между стандартной свободной энергией и константой равновесия реакции. В состоянии равновесия ΔG= 0. Уравнение тогда приобретает следующий вид:
0 = ΔG0 + RTln ([C] [D] / [A] [B])
ΔG0 = -RTlnKeq
Ферменты не влияют на константу равновесия, следовательно, ускоряют только самопроизвольно идущие реакции, где ΔG меньше нуля. Но в клетке множество реакции особенно в процессах биосинтеза изменение свободной энергии больше нуля, чтобы эта реакция прошла необходимо сообщать энергию системе, что в химии чаше всего происходит за счет нагрева системы, в биологических системах это невозможно из-за прежде всего денатурацию белка. Поэтому в биологических системах появился обходной путь: система сопряженных реакций. В одной точке пространства (в данном случае каталитическом центре) происходят одновременно две реакции: у одной ΔG положительно, у другой отрицательно. Если суммарное ΔG отрицательно то обе реакции идут спонтанно. Именно так обеспечивается приток энергии в систему. Наиболее распространенной сопряженной реакцией является гидролиз АТФ.
Главный определитель хода реакции – свободная энергия (ΔG)
В клетке есть очень нужная реакция 1, но ΔG1> 0 – реакция 1 не идет, поэтому в каталитическом центре есть сопряженная реакция 2, ΔG2 <0 – реакция 2 идет. В каталитическом центре находятся субстраты обеих реакций.
Пойдет ли реакция 1 в этой точке определяется суммарным изменением свободной энергии в данной системе (каталитическом центре):Σ ΔG = ΔG1 +ΔG2;
если Σ ΔG> 0 – реакция 1 не идет
если Σ ΔG <0 – реакция 1 идет.
Необходимых реакций для клетки, чья сводная энергия больше нуля очень много, но вторая сопряженная реакция, как донор энергии для системы должна быть унифицирована. Следовательно, необходима реакция 2 (сопряженная) – универсальная и обеспечивающая Σ ΔG <0. Так сложилось в процессе эволюции, что универсальной сопряженной реакцией стала реакция гидролиза АТФ.
АТФ – это универсальная энергетическая валюта в биологических системах, представляет собою богатую энергией молекулу, что обусловлено наличием в ней двух ангидридных связей. Электростатическое отталкивание между этими отрицательно заряженными группами уменьшается при гидролизе ATФ. AДФ и Фн, стабилизируются под действием резонанса в большей степени, чем АТФ. Гидролиз АТФ сдвигает равновесие сопряженной реакции примерно в 108 раз.
Кроме того, АТФ достаточно устойчивая молекула и время ее жизни достаточно велико. Таким образом, для обеспечения процессов биосинтеза клетка постоянно нуждается в притоке энергии – АТФ. В ходе синтеза организм переводит более окисленные вещества в менее окисленные, для чего необходимы доноры протонов и электронов: NADH, NADPH и FADH2.
Совокупность реакций окисления различных биомолекул (углеводов, липидов, аминокислот, нуклеотидов) направленных на синтез АТФ и восстановление NAD+, NADP+ и FAD+ получила название – энергетический метаболизм клетки или катаболизм. Тогда как совокупность реакций биосинтеза биологических молекул и сборки из них клеточных компонентов называют пластическим обменом или анаболизмом.
Таким образом общий метаболизм клетки можно разделить на две большие части: катаболизм и анаболизм.
Энергетический обмен клетки подразделяется в зависимости от класса окисляемых соединений на несколько направлений:
окисление углеводов;
окисление липидов;
окисление белков.
Белки выполняют множество других важных функций, поэтому расщепляются реакциях энергетического обмена в небольших количествах или в случае дефицита других молекул источников энергии. Основными молекулами вступающими в реакции катаболизма являются углеводы и липиды (триацилглицериды).
Углеводы являются одним из основных источников энергии для клетки причем выделяют два пути окисления углеводов: бескислородное (или анаэробное) и с участием кислорода (аэробное). К анаэробным путям окисления углеводов относятся гликолиз, пентозофосфатный шунт и разнообразные виды брожения. Гликолиз является не только путем окисления моносахаридов в параллельным синтезом АТФ, но и прелюдией к путям аэробного окисления или клеточному дыханию.
Рассмотрим пути окисления углеводов более подробно.
Гликолиз
Гликолиз – это совокупность реакций превращения глюкозы в пируват. У аэробных организмов гликолиз служит как бы прелюдией к циклу трикарбоновых кислот и цепи переноса электронов, в ходе которых запасается большая часть свободной энергии, содержащейся в глюкозе. Открытие гликолиза последовало непосредственно за экспериментами Бюхнера, а также Гардена и Ионга по сбраживанию сахара дрожжевым соком. Вскоре с изучением спиртового брожения слились исследования другого направления, связанные с изучением мышц. Физиологи заинтересовались процессом, благодаря которому изолированная мышца могла получать энергию для сокращения в отсутствие кислорода. Хилл показал, что энергию обеспечивает превращение гликогена в лактат, а несколько позднее Мейергоф продемонстрировал, что происходящие при этом химические реакции сходны с теми, которые наблюдаются при спиртовом брожении. Установление структуры изучению гликолиза, проведенными Эмбденом во Франкфурте и Парнасом в Польше. Таким путем вскоре была выяснена последовательность реакций гликолиза (путь Эмбдена – Мейергофа – Парнаса). Все ферменты, катализирующие отдельные стадии процесса, к настоящему времени выделены, закристаллизованы и подробно изучены. Все десять реакций гликолиза протекают в гиалоплазме.
Основным моносахаридом поступающим в гликолиз является глюкоза. В животной клетке присутствуют как свободная глюкоза (поступившая через мембрану из внешней среды), так и продукт распада гликогена (животного полисахарида – мономером которого является глюкоза).
Вся последовательность реакций гликолиза может быть разбита на четыре стадии (последовательность реакций гликолиза представлена на рисунке 1):
подготовка к разрыву цепи;
разрыв цепи и установление равновесия между триозофосфатами;
окислительное образование АТФ
превращение 3-фосфоглицерата в пируват.
Первый этап – подготовка к разрыву цепи:
В гликолиз могут поступать различные свободные шестиуглеродные моносахариды (гексозы) глюкоза, фруктоза и другие, а также глюкоза из гликогена. В первой реакции происходит фосфорилирование молекулы глюкозы ее осуществляет фермент гексокиназа во всех органах и тканях или глюкокиназа в печени. Оба фермента относятся к классу трансфераз, и осуществляют перенос фосфатной группы с молекулы АТФ на молекулу глюкозы с образованием глюкозо-6-фосфата, АТФ в данном случае является как донором энергии, так и донором фосфатной группы, за счет затраты АТФ происходит, во-первых, образование активной формы моносахарида, глюкозо-фосфата, во-вторых, обеспечивается необратимость реакций гликолиза. Разница между ферментами заключается в специфичности (глюкокиназа более специфична взаимодействует только с глюкозой, гексокиназа менее специфична фосфорилирует все гексозы); в распределении в организме (глюкокиназа в печени, гексокиназа в остальных тканях организма); в регуляции (смотри ниже). Второй путь входа через глюкозо-1-фосфат. Так входят в гликолиз глюкоза из гликогена и галактоза.
Образовавшийся фруктозо-6-фосфат под действием фосфофруктокиназы превращается 1,6-фруктозобифосфат. Фосфофруктокиназа также относится к классу трансфераз. Донором энергии и фосфатной группы в этой реакции является молекула АТФ. То есть затрачивается еще одна молекула АТФ. Это делает последовательность реакции гликолиза окончательно необратимой, а кроме того образуется симметричная молекула, что важно для второго этапа гликолиза.
Вторая стадия – разрыв цепи и установление равновесия между триозофосфатами
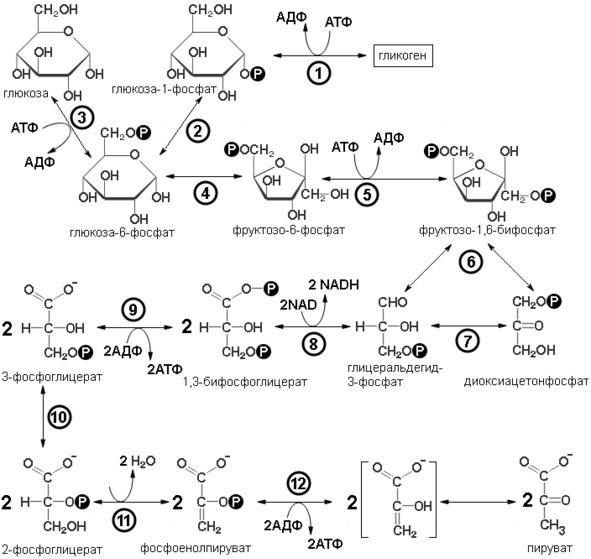
Рисунок 1: Схема реакций гликолиза, цифрами в кружках названия ферментов. 1 – гликогенфосфорилаза; 2-глюкозофосфатизомераза; 3 – гексокиназа (глюкокиназа в печени); 4 – глюкозо-6-фосфатизомераза; 5 – фосфофруктокиназа; 6 – альдолаза; 7 – триозофосфатизомераза; 8 – глицероальдегид-3-фосфат оксидоредуктаза фосфорилирующая; 9 – 1,3-бифосфоглицераткиназа; 10 – фосфоглицератизомераза; 11 – енолаза; 12 – пируваткиназа (черный круг с буквой Р в центре обозначает фосфатную группу).
Гликоген – это запасающий полисахарид животных состоящий из α-D-глюкозы. Под действием гликоген фосфорилазы происходит отщепление остатков глюкозы от полимерной цепи гликогена, параллельно происходит присоединение фосфатной группы к молекуле глюкозы с образованием глюкозо-1-фосфата, донором и энергии, и фосфатной группы является молекула АТФ. Через образование глюкозо-1-фосфата в гликолиз поступает галактоза. К галактозе присоединяется УТФ с образованием УДФ-галактозы, которая под действием эпимеразы превращается в УДФ-глюкозу. УДФ-глюкоза распадается на глюкозо-1-фосфат и УМФ, данную реакцию катализирует УДФ-глюкозопирофосфорилаза. Образовавшийся глюкозо-1-фосфат изомеризуется в глюкозо-6-фосфат фосфоглюкоизомеразы. Таким образом образуется активная форма глюкозы глюкозо-6-фосфат. Затем происходит изомеризация глюкозо-6-фосфата в фруктозо-6-фосфат под действием изомеразы. Фруктозо-6-фосфат может образовываться и из свободной фруктозы под действием гексокиназы.
После образования 1,6-фруктозобифосфата начинается вторая стадия гликолиза. Расщепление фруктозодифосфата катализируется альдолазой, относящейся к классу лиаз; в результате образуются глицеральдегид-3-фосфат и диоксиацетонфосфат. Между этими двумя триозофосфатами в результате действия изомеразы устанавливается равновесие. Таким образом, обмен обеих половинок гексозы может пойти по пути превращения в пируват через глицеральдегид-3-фосфат. В то же время для диоксиацетонфосфата существует и другой путь, связанный с восстановлением в глицерофосфат – предшественник липидов и в промежуточный продукт в некоторых типах брожения. Но в случае гликолиза дигидроксиацетонфосфат под действием триозофосфатизомеразы легко преобразуется в глицероальдегид-3-фосфат, и между этими продуктами устанавливается равновесие, но глицеральдегид-3-фосфат, постоянно изымается в следующие реакции гликолиза, поэтому равновесие сдвигается в сторону изомеризации дигидроксиацетонфосфата в глицероальдегид-3-фосфат, и это происходит практически количественно, поэтому считается, что весь дигидроксиацетонфосфат преобразуется в глицероальдегид-3-фосфат, и принято удваивать продукты всех последующих реакций. Глицероальдегид-3-фосфат поступает в третью стадию.
Третья стадия – окислительное образование АТФ
Глицеральдегид-3-фосфат окисляется под действием глицеральдегид-3-фосфат оксидоредуктазы фосфорилирующей акцептором электронов является NAD+, восстанавливающийся до NADH. В результате образуется короткоживущий промежуточный продукт 1,3-бифосфоглицерат, вторая фосфатная группа поступает из раствора. 1,3-бифосфоглицерат является нестабильным соединением, причем ΔG гидролиза связи между карбоксильной и фосфатной групппировками в 1 положении меньше нуля, а по модулю больше энергии гидролиза фосфоангидридной связи АТФ. Такие соединения называют макроэргическими. 1,3-бифосфоглицерат распадается под действием 1,3-бифосфоглицераткиназы и отщепляемая фосфатная группа переносится на молекулу АДФ и в результата образуются 3-фосфоглицерат и АТФ. Такой тип синтеза АТФ называют субстратным фосфорилированием. То есть фосфатная группа переносится с макроэргического соединения (энергия гидролиза фосфатной группы по модулю больше энергии гидролиза АТФ, поэтому выделившейся энергии достаточно для фосфорилирования АДФ и образования АТФ). Образовавшийся 3-фосфоглицерат поступает в 4-й этап гликолиза.
Четвертая стадия – превращение 3-фосфоглицерата в пируват
3-фосфоглицерат, изомеризуется в 2-фосфоглицерат под действием 3—2 фосфоглицерат изомеразы. 2-фосфоглицерат дегидратируется енолазой (2-фосфоглицератгидролиазой), происходит отщепление молекулы воды образуется фосфоенолпируват (ФЕП), который является «макроэргическим» соединением, фосфорильная группа которого может быть легко перенесена на AДФ (под действием фермента пируваткиназы); остающийся при этом енол пировиноградной кислоты самопроизвольно превращается в значительно более устойчивый пируват. Поскольку на каждую молекулу глюкозы образуются две молекулы фосфоенолпирувата, этот процесс восполняет затрату двух молекул АТФ, происходящую на начальных стадиях образования фруктозо-1,6-дифосфата из глюкозы.
Суммарная реакция гликолиза:
Глюкоза +2АТФ +2NAD +4АДФ = 2Пируват +2АДФ +4АТФ +2NADH
Суммарный энергетический выход всего 2 АТФ.
Регуляция гликолиза
Регуляция гликолиза происходит на трех этапах:
Вход глюкозы в гликолиз (это естественно, так как если процесс не нужен, то его проще не запускать вообще, а не обрывать на половине).
Фосфофофруктокиназная реакция (реакция необратима, кроме того в ней затрачивается АТФ).
Пируваткиназная реакция (реакция также необратима, а кроме того важным является процесс утилизации образующегося пирувата).
Теперь необходимо рассмотреть эти этапы более подробно.
Вход глюкозы в гликолиз
Как было рассмотрено выше, глюкоза входит в гликолиз из свободной глюкозы или из гликогена. Свободная глюкоза фосфорилируется гексокиназой, активность этого фермента регулируется: происходит ингибирование продуктом реакции глюкозо-6-фосфатом. Поэтому накопление глюкозо-6-фосфата резко снижает скорость гексокиназной реакции, в результате нет затрат АТФ, так как глюкозо-6-фосфат во всех тканях кроме печени направляется на реакции окисления. Тогда как в печени накопление глюкозо-6-фосфата не происходит, так как излишки запасаются в виде гликогена, поэтому в печени работает другой фермент – глюкокиназа, не ингибируемый продуктом реакции.
При входе глюкозы из гликогена первая реакция гликогенфосфорилазная, регуляция гликогенфосфорилазы происходит двумя путями. Первый вариант посттрансляционная модификация.
В скелетных мышцах этот фермент присутствует в двух формах – в каталитически активной фосфорилированной форме (фосфорилаза а) и в значительно менее активной дефосфорилированной форме (фосфорилаза b) (схема перехода изорм представлена на рисунке 2). Фосфорилаза а была получена в кристаллическом виде (мол. масса 190 кDa). Ее молекулы состоят из двух идентичных субъединиц, каждая из которых содержит существенный для каталитической активности остаток серина в фосфорилированной форме. Скорость превращения структурных единиц гликогена в глюкозо-1-фосфат регулируется в мышцах соотношением активной фосфорилазы а и менее активной фосфорилазы b. Взаимопревращения двух этих форм гликогенфосфорилазы происходят под действием специфичных ферментов, катализирующих процесс ковалентной модификации фосфорилазы. Фосфорилаза а превращается в менее активную фосфорилазу b под действием фермента, называемого фосфатазой фосфорилазы а; этот фермент, катализируя гидролитический разрыв связей, удаляет из молекулы фосфорилазы а фосфатные группы, необходимые для каталитической активности.
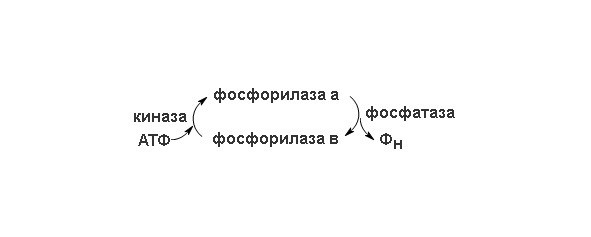
Рисунок 2. Схема перехода двух форм фосфорилазы.
Фосфорилаза b вновь превращается в активную фосфорилазу а под действием фермента, называемого киназой фосфорилазы b; он катализирует реакцию, в ходе которой АТФ фосфорилирует остатки серина в активном центре молекулы фосфорилазы b, что и приводит к образованию фосфорилазы а. Таким образом, благодаря действию двух ферментов, фосфатазы фосфорилазы а и киназы фосфорилазы b, соотношение активной фосфорилазы а и сравнительно мало активной фосфорилазы b в клетке может изменяться. В мышцах действует второй механизм регуляции гликогенфосфорилазной активности. Фосфорилаза b, сравнительно мало активная форма, может становиться более активной в результате нековалентного связывания с аллостерическим модулятором этого фермента, которым является AMФ; концентрация же AMФ в мышцах возрастает по мере распада АТФ в сократительных системах. Активации фосфорилазы b под действием AMФ препятствует АТФ, выступающий в роли отрицательного модулятора. Таким образом, активность фосфорилазы b определяется соотношением AMФ и ATФ. В отличие от фосфорилазы b фосфорилаза а не активируется AMФ; поэтому фосфорилазу а называют иногда AMФ-независимой формой, а фосфорилазу b AMФ-зависимой.
Таким образом, есть два механизма регуляции, которым подчиняется гликогенфосфорилаза скелетной мышцы: 1) ковалентная модификация посредством фосфорилирования или дефосфорилирования остатков серина в активном центре фермента и 2) аллостерическая регуляция фосфорилазы b путем нековалентного связывания с AMФ или АТФ. В покоящейся мышце почти вся фосфорилаза находится в неактивной, или b -форме, поскольку в такой мышце концентрация АТФ. В печени гликогенфосфорилаза также присутствует в а- и b-форме; в принципе ферменты печени функционируют подобно мышечным, от которых они, впрочем, несколько отличаются по своей структуре и регуляторным свойствам. Расщепление гликогена в печени имеет иное назначение, нежели в мышцах; этот процесс служит источником свободной глюкозы крови. Под действием фосфорилазы печени образуется глюкозо-1-фосфат, который затем превращается в глюкозо-6-фосфат, являющийся уже непосредственным предшественником свободной глюкозы. Реакция, в ходе которой образуется D-глюкоза крови, катализируется ферментом глюкозо-6-фосфатазой.
Второй этап регуляции гликолиза – регуляция реакции образования фруктозо-1,6-дифосфата, катализируемой фосфофруктокиназой. Фосфофруктокиназа (ФФК) – это сложный аллостерически регулируемый фермент, управляемый многими аллостерическими положительными и отрицательными модуляторами. В скелетных мышцах активность фосфофруктокиназы определяется концентрациями субстратов этого фермента (АТФ и фруктозо-6-фосфата) и его продуктов (AДФ и фруктозо-1,6-дифосфата); все эти соединения играют роль аллостерических регуляторов. Очень важны также в качестве регуляторов AMФ, цитрат, ионы Mg2+, фосфат и некоторые другие метаболиты, присутствующие в мышечной ткани. Однако, хотя регуляции ФФК зависит от сложного взаимодействия ряда факторов, главными отрицательными модуляторами этого фермента являются АТФ и цитрат, а самыми активными положительными модуляторами AMФ и фруктозо-1,6-дифосфат. Всякий раз, когда при очень активном мышечном сокращении концентрация АТФ падает, а энергии требуется больше, фосфофруктокиназная активность усиливается, даже если концентрация фруктозо-6-фосфата очень низка. Если, однако, уровень АТФ в клетке уже высок по сравнению с уровнем AДФ и AMФ, то кажущееся сродство фосфофруктокиназы к фруктозо-6-фосфату сильно. В этом случае фосфофруктокиназа будет катализировать реакцию лишь при сравнительно высокой концентрации фруктозо-6-фосфата Цитрат, один из промежуточных продуктов цикла лимонной кислоты, усиливает ингибирование фосфофруктокиназы высокими концентрациями АТФ. В то же время повышение концентрации AMФ, образующегося в результате аденилаткиназной реакции в сокращающейся мышце, служит очень мощным стимулирующим модулятором и противодействует ингибирующему влиянию АТФ на фосфофруктокиназную реакцию.
В результате всех этих сложных аллостерических взаимодействий скорость реакции, катализируемой фосфофруктокиназой, возрастает иногда в сотни раз при переходе скелетной мышцы из состояния покоя к состоянию максимальной активности.
Третьим регулируемым этапом гликолиза является пируваткиназная реакция. Пируваткиназа также принадлежит к числу аллостерических ферментов. Этот фермент встречается, по меньшей мере, в трех изоформах, которые отличаются друг от друга по распределению в тканях и по реакции на различные модуляторы. При высоких концентрациях АТФ кажущееся сродство пируваткиназы к фосфоенолпирувату сравнительно невелико и соответственно невелика скорость пируваткиназной реакции при обычных концентрациях фосфоенолпирувата. Пируваткиназу ингибируют также ацетил-СоА и высокомолекулярные жирные кислоты – соединения, играющие важную роль в качестве топлива для цикла лимонной кислоты. Таким образом, когда в клетке уже велика концентрация АТФ или когда в ней уже достаточно топлива для процесса дыхания, обеспечивающего клетку энергией, гликолиз ингибируется за счет либо фосфофруктокиназы, либо пируваткиназы (в зависимости от условий). В то же время при низких концентрациях АТФ кажущееся сродство пируваткиназы к фосфоенолпирувату возрастает, и это позволяет ферменту переносить фосфатные группы от фосфоенолпирувата на AДФ даже при относительно низкой концентрации фосфоенолпирувата. Некоторые аминокислоты также действуют как модуляторы пируваткиназной активности, главным образом в печени. Во всех клетках гликолиз регулируется с очень высокой эффективностью, напоминающей действие компьютера, а потому изменения концентрации различных метаболитов могут влиять на его общую скорость.
Гликолиз – процесс анаэробного окисления моносахаридов, в результате которого происходит синтез АТФ. У аэробных организмов АТФ синтезируется еще и в процессах клеточного дыхания, в которых утилизируются другие продукты гликолиза (пируват и NADH), поэтому направление реакций гликолиза сдвинуто в сторону образования продуктов метаболитического пути.
Брожение
У аэробных организмов пируват и NADH, образовавшиеся в ходе гликолиза, утилизируются в ходе клеточного дыхания. У анаэробных организмов этого не происходит, поэтому необходима надстройка. Этой надстройкой является процесс брожения.
Брожение – это тип анаэробного окисления пирувата.
В настощее время описано множество путей брожения. Все они выявлены у прокариотических организмов. Но два типа бружения встречаются не только у прокариот, но и у эукариот. У эукариотических организмов обнаружены гомоферментативное молочнокислое и спиртовое брожение.
Гомоферментативное молочнокислое брожение
Гомоферментативное молочнокислое брожение получило свое название (схема представлена на рисунке 3), из-за того, что происходит одна реакция осуществляемая ферментом лактат дегидрогеназой молекула пирувата восстанавливается до лактата и донором протонов и электронов является NADH.
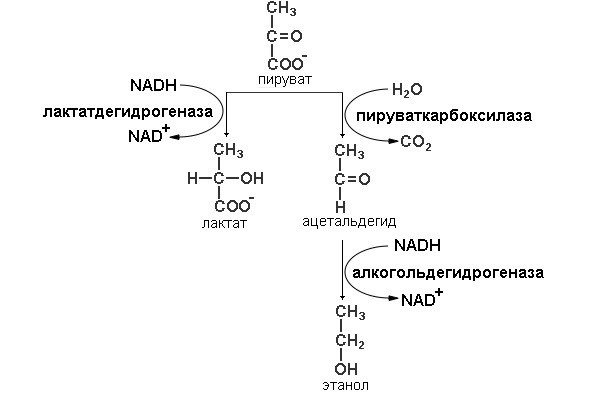
Рисунок 3: Схема реакций гомоферментативного молочнокислого и спиртового видов брожения
Данный тип брожения характерен для многих бактерий. Многие возбудители заболеваний, например, стафилококки и стрептококки, осуществляют этот тип брожения. Но данный брожения встречается и у полезных бактерий. Молочнокислые бактерии используются при изготовлении молочнокислых продуктов, сыров, сырокопченых колбас, при квашении капусты, засолке огурцов, силосовании при заготовке кормов. Также молочнокислое брожение встречается и у эукариот. Паразиты крови (простейшие, паразитирующие в крови млекопитающих (возбудители малярии, сонной болезни), также используют данный тип утилизации пирувата.
Лактатдегидрогеназа присутствует и в тканях млекопитающих. Хотя в обычных условиях наши мышцы получают вполне достаточные количества кислорода, чтобы произошло окисление пирувата и образование АТФ аэробным путем, бывают обстоятельства, когда поступление кислорода оказывается недостаточным. Например, при крайнем напряжении сил, когда уже весь запас кислорода израсходован, мышечные клетки образуют лактат путем брожения. Более того, в белых мышцах рыб или домашней птицы аэробный метаболизм относительно невелик, и основным конечным продуктом оказывается L-лактат. В организме человека есть такие ткани, которые слабо снабжаются кровью, например, хрусталик и роговица глаза. В клетках этих тканей окислительный метаболизм выражен слабо, а энергия в основном образуется при сбраживании глюкозы в лактат. Часть лактата, образующегося в мышцах и других тканях, поступает в кровь и переносится в печень, где он снова окисляется в пируват. Меньшая часть пирувата затем окисляется в цикле трикарбоновых кислот, но большая его часть снова превращается в глюкозу. Последняя может опять поступать в кровь и возвращаться в мышцы. Весь этот процесс называется циклом Кори.
Спиртовое брожение
У дрожжей и у других микроорганизмов, сбраживающих глюкозу не до лактата, а до этанола и СО2, путь ферментативного расщепления глюкозы совпадает с описанным выше для анаэробного гликолиза на всем протяжении, за исключением этапа, катализируемого лактатдегидрогеназой (схема представлена на рисунке 3). В дрожжевых клетках, которые не содержат фермента, аналогичного лактатдегидрогеназе мышечной ткани, этот этап заменен двумя другими реакциями. В первой из них продукт расщепления глюкозы пируват теряет свою карбоксильную группу под действием пируватдекарбоксилазы. Эта реакция представляет собой простое декарбоксилирование; реального окисления пирувата при этом не происходит. Для проявления каталитической активности пируватдекарбоксилазе требуется Mg2+. С молекулой этого фермента прочно связан кофермент тиаминпирофосфат. На последнем этапе спиртового брожения ацетальдегид восстанавливается до этанола за счет NADH, образовавшегося при окислении глицеральдегид-3-фосфата; эта реакция катализируется алкогольдегидрогеназой.
Таким образом, конечными продуктами спиртового брожения являются этанол и СО2, а не лактат. Пируватдекарбоксилаза содержится в клетках пивных дрожжей и других микроорганизмов, осуществляющих спиртовое брожение. В животных тканях этот фермент отсутствует. Лишены пируватдекарбоксилазы также организмы, осуществляющие молочнокислое брожение, например молочнокислые бактерии. Биохимия спиртового брожения лишь недавно изучена настолько хорошо, чтобы можно было представить этот процесс в виде ряда последовательных ферментативных реакций.
Что же касается виноделия и пивоварения, то это весьма древние искусства, освоенные людьми за сотни лет до того, как родилась сама наука химия. Более того, сами старинные рецепты приготовления пива и вина сыграли в свое время важную роль, послужив ключом к некоторым фундаментальным открытиям на заре развития биологии и биохимии.
Так, в 1856 г. Луи Пастер впервые убедительно показал, что сбраживание сахара в спирт вызывается микроорганизмами, а не какими-то магическими влияниями. Французские виноделы пригласили Пастера для того, чтобы он помог им выяснить, почему в иные годы вино не удается и превращается в уксус. Пастер в своих экспериментах, ставших классическими, показал, что в стерильных растворах глюкозы брожения не происходит, тогда как в растворах, соприкасающихся с нефильтрованным воздухом, брожение идет, и причина этого заключается в том, что в раствор попадают из воздуха споры дрожжей и других микроорганизмов.
Из налета на гроздьях свежесрезанного винограда Пастер выделил культуры дрожжей и доказал, что именно дрожжи ответственны за брожение, происходящее в соке, отжатом из раздавленного винограда. Он выяснил также, что превращение спирта в уксусную кислоту вызывается другими видами микроорганизмов – уксуснокислыми бактериями; эти аэробные организмы окисляют этанол с образованием уксусной кислоты.
Пентозофосфатный путь
Пентозофосфатный путь является альтернативным путем окисления глюкозы. Он включает несколько этапов, в результате функционирования которых из трех молекул глюкоза-6-фосфата образуются три молекулы СО2 и три молекулы пентоз. Последние используются для регенерации двух молекул глюкозо-6-фосфата и одной молекулы глицеральдегид-3-фосфата. Поскольку из двух молекул глицеральдегид-3-фосфата можно регенерировать молекулу глюкоза-б-фосфата, глюкоза может быть полностью окислена при превращении по пентозофосфатному пути.
У растений часть реакций пентозофосфатного пути участвует также в образовании гексоз из СО2 при фотосинтезе. Пентозофосфатный путь называют иногда пентозным шунтом, гексозомонофосфатным путем или фосфоглюконатным окислительным путем. Открытие Отто Варбургом (Otto Warburg) в 1931 г. глюкозо-6-фосфат-дегидрогеназы, первого фермента этого пути, сделало возможной его полную расшифровку, которую осуществили Фриц Липман, Фрэнк Дикенс, Бернард Хорекер и Эфроим Рэкер.
Пентозофосфатный цикл не приводит к синтезу АТР, он выполняет две главные функции: 1) образование NADPH для восстановительных синтезов, таких, как синтез жирных кислот и стероидов; 2) обеспечение рибозой синтеза нуклеотидов и нуклеиновых кислот. Ферменты пентозофосфатного пути локализованы во внемитохондриальномпространстве клеткив цитозоле. Как и в процессе гликолиза, окисление осуществляется путем дегидрогенирования, однако акцептором водорода в этом случае служит не NAD, а NADP.
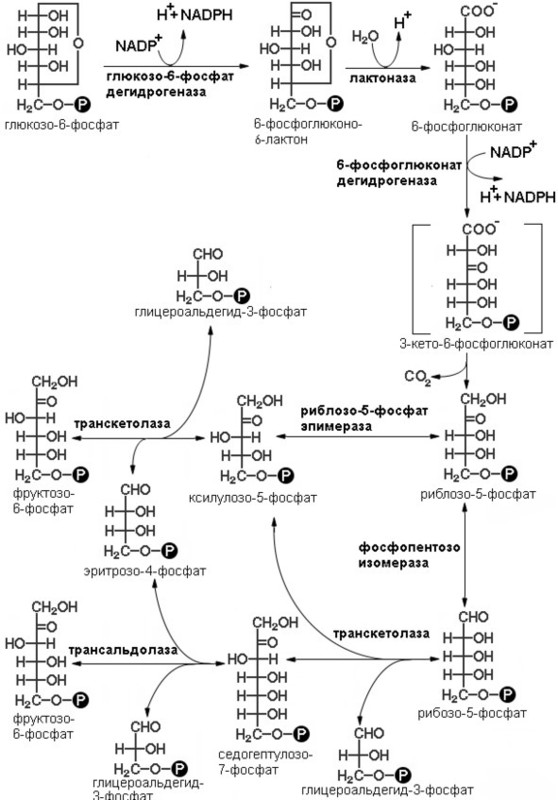
Рисунок 4: Схема реакций пентозофосфатного шунта (черный круг с буквой Р в центре обозначает фосфатную группу).
Последовательность реакций пути можно разделить на две фазы: окислительную и неокислительную (схема реакций представлена на рисунке 4). В реакциях первой фазы глюкоза-6-фосфат дегидрогенируется и декарбоксилируется с образованием рибулозо-5-фосфата. В ходе второй фазы рибулозо-5-фосфат превращается снова в глюкозо-6-фосфат в результате серии реакций, в которых главную роль играют два фермента: транскетолаза и трансальдолаза
Окислительная фаза пентозофосфатного пути начинается с дегидрирования глюкозо-6-фосфата при С-1, реакции, катализируемой глюкозо-6-фосфат-дегидрогеназой.
Фермент высокоспецифичен в отношении NADP+; Км для NAD+ примерно в тысячу раз выше, чем для NADP+. Продуктом реакции является 6-фосфоглюконо-δ-лактон, внутримолекулярный эфир, с эфирной связью между С-1-карбоксильной группой и гидроксилом при С-5. Следующий этап – гидролиз 6-фосфоглюконо- δ -лактона специфической лактоназой, дающий 6-фосфо-глюконат. Этот шестиуглеродный сахар подвергается затем окислительному декарбоксилированию 6-фосфоглюконат – дегидрогеназой с образованием рибулозо-5-фосфата. Акцептором электронов вновь служит NADP+. (смотри рисунок). Конечным этапом синтеза рибозо-5-фосфата является изомеризация рибулозо-5-фосфата фосфопентозо-изомеразой. Эта реакция подобна гликолитическим реакциям:
Глюкозо-6-фосфат ↔ Фруктозо-6-фосфат
Дигидроксиацетонфосфат ↔ Глицеральдегид-3-фосфат.
Все три кетозо-альдозные изомеризации идут через образование ендиольного промежуточного продукта.
Окислительная фаза пентозофосфатного пути иногда считается основной и неокислительная рассматривается как связка с гликолизом. Это связано с тем фактом, что эти фазы могут идти как независимо друг от друга, так вместе. В ходе неокислительной фазы пентозофосфатного пути происходит регенерация рибозо-5-фосфата в глюкозо-6-фосфат. Основную роль в этом процессе играют два фермента: транскетолаза и трансалъдолаза. Эти же ферменты создают обратимую связь между пентозофосфатным путем и гликолизом, катализируя следующие три реакции:
Транскетолаза переносит двухуглеродную группу, включающую 1-й и 2-й атомы углерода кетозы, на альдегидный углерод альдозного сахара. Происходит, следовательно, превращение кетосахара в альдозу, содержащую на два атома углерода меньше, и одновременное превращение альдосахара в кетозу, содержащую на два атома углерода больше. Коферментом реакции является тиаминидифосфат (в его состав входит тиамин – витамин группы В), для ее протекания необходимы ионы Mg2+. Переносимая двухуглеродная группа является, вероятно, гликоальдегидом, связанным с тиаминдифосфатом, т. е. «активным гликольальдегидом». Транскетолаза катализирует перенос двухуглеродной группы с ксилулозо-5-фосфата на рибозо-5-фосфат с образованием семиуглеродной кетозы седогептулозо-7-фосфата и альдозы глицеральдегид-3-фосфата. Эти два продукта далее вступают в следующую реакцию, называемую трансальдолазной. Трансальдолаза осуществляет перенос трехуглеродного фрагмента, «активного дигидроксиацетона» (атомы углерода 1 – 3), кетозы седогептулозо-7-фосфата на альдозу глицеральдегид-3-фосфат; в результате образуются кетоза фруктоза-6-фосфат и четырехуглеродная альдоза эритрозо-4-фосфат. Следующая реакция снова катализируется транскетолазой. В этой реакции ксилулозо-5-фосфат служит донором «активного гликоальдегида». Роль акцептора выполняет образовавшийся ранее эритрозо-4-фосфат. Продуктами этой реакции являются фруктоза-6-фосфат и глицеральдегид-3-фосфат.
Итак, избыток рибозо-5-фосфата, образованный в пентозофосфатном пути, может количественно превращаться в промежуточные продукты гликолиза.
Значение метаболического пути для различных тканей можно оценить по его активности. Пентозофосфатный путь активно протекает в печени, жировой ткани, коре надпочечников, щитовидной железе, эритроцитах, семенниках и в молочных железах в период лактации; он неактивен в нелактирующей молочной железе и малоактивен в скелетных мышцах. Все ткани, в которых активность данного пути высока, используют в реакциях восстановительного синтеза NADPH, например в реакциях синтеза жирных кислот, стероидов, аминокислот (с участием глутаматдегидрогеназы) или восстановленного глутатиона в эритроцитах. Вероятно, в условиях активного липогенеза или при наличии любой системы, утилизирующей NADPH, возрастает активная деградация глюкозы по пентозофосфатному пути в связи с увеличением отношения NADP+/NADPH. В условиях, которые возникают после приема пищи, может индуцироваться синтез глюкоза-6-фосфатдегидрогеназы и 6-фосфоглюконатдегидрогеназы.
Регуляция скорости функционирования пентозофосфатного пути
Первая реакция окислительной ветви пентозофосфатного пути, дегидрирование глюкозо-6-фосфата, по существу необратима. Действительно, при физиологических условиях эта реакция лимитирует скорость процесса и выполняет функцию «контрольного пункта». Наиболее важным регуляторным фактором является концентрация NADP+, акцептора электронов при окислении глюкозо-6-фосфата в 6-фосфоглюконо-лактон. Кроме того, NADPH конкурирует с NADP+ за связывание с ферментом, и АТР конкурирует с глюкозо-6-фосфатом. Отношение концентрации NADP+ к концентрации NADPH в цитозоле печени крыс, содержащихся на полноценном ра
...