автордың кітабын онлайн тегін оқу Микробиология. Практикум для выполнения лабораторно-практических работ
Р. Т. Маннапова
Микробиология. Практикум для выполнения лабораторно-практических работ
Учебник
Информация о книге
УДК 579(076.5)
ББК 28.4я73
М23
Автор:
Маннапова Р. Т. – доктор биологических наук, профессор кафедры микробиологии и иммунологии Российского государственного аграрного университета — Московской сельскохозяйственной академии им. К. А. Тимирязева.
Рецензенты:
Ларионова О. С., – доктор биологических наук, доцент, заведующая кафедрой микробиологии, биотехнологии и химии ФГБОУ ВО «Саратовский государственный аграрный университет им. Н. И. Вавилова»;
Дюльгер Г. П., – доктор ветеринарных наук, профессор, заведующий кафедрой морфологии и ветеринарии ФГБОУ ВО «Российский государственный аграрный университет – Московская сельскохозяйственная академия им. К. А. Тимирязева».
В учебнике изложены методы морфологических, физиологических исследований микроорганизмов, лабораторной диагностики инфекционных болезней, микозов и микотоксикозов животных, санитарной микробиологии, серологических и иммунологических методов исследований, методов молекулярной диагностики. По каждой теме представлена теория вопроса, описаны материалы и оборудование, методика выполнения, даны задания для выполнения работы и вопросы для контроля знаний. В конце учебника представлен тестовый контроль знаний по всем изложенным темам. Для облегчения усвоения материала приведен терминологический словарь. Имеются приложения.
Содержание практикума позволяет выбирать темы исходя из региональных особенностей и состояния животноводства в целом по Российской Федерации.
Учебник предназначен для подготовки магистров/бакалавров с учетом требований программы ФГОС ВО по направлению 36.04.01/36.03.01 «Ветеринарно-санитарная экспертиза»..
УДК 579(076.5)
ББК 28.4я73
© Маннапова Р. Т., 2018
© ООО «Проспект», 2018
Посвящается светлой памяти
моих родителей –
Тимергалея Фахразетдиновича
и Нурзиды Динисламовны Рафиковых
Предисловие
Учебник «Микробиология» предназначен для магистров и (или) бакалавров с учетом требований программы федеральных государственных образовательных стандартов высшего образования (ФГОС ВО) по направлению 36.04.01/36.03.01 «Ветеринарно-санитарная экспертиза» при выполнении лабораторных и практических занятий. Он может быть также использован при подготовке специалистов по направлению 36.05.01 «Ветеринария» аспирантами, работниками ветеринарных лабораторий и служб в ходе научных исследований и факультативных занятий.
Издание имеет форму удобного практикума и позволяет преподавателям названных дисциплин выбирать темы с учетом местных особенностей, состояния животноводства как в регионе, так и в целом в Российской Федерации, а также современных международных требований к подготовке востребованных конкурентоспособных специалистов для ветеринарии.
Практикум состоит из четырех разделов.
В разделе I «Общая микробиология: морфология и физиология микроорганизмов» рассматриваются принципы работы в микробиологической лаборатории, виды микроскопирования, инструкции по приготовлению питательных сред, приемы стерилизации, вопросы морфологии, физиологии, биохимии и антибиотикорезистентности микроорганизмов.
Раздел II «Инфекционные болезни животных, микозы и микотоксикозы» содержит темы лабораторно-практических занятий (ЛПЗ), посвященных основным инфекционным болезням, микозам и микотоксикозам, диагностику и профилактику которых современному магистру/бакалавру, ветеринарно-санитарному эксперту, а также специалисту — ветеринарному врачу необходимо уметь выполнять в первую очередь — для своевременного принятия мер по их профилактике, ликвидации последствий, предупреждения заражения людей через животноводческую продукцию, обеспечения населения экологичной и здоровой продукцией животного происхождения.
В разделе «Санитарная микробиология» представлены темы ЛПЗ по санитарно-микробиологическим методам исследования воды, почвы и воздуха.
Раздел IV «Иммунология. Серологические и иммунологические методы исследований» включает темы ЛПЗ, посвященные серологическим (РА, РП, РСК, МФА, РН) и современным иммунологическим методам исследований клеточных и неспецифических факторов иммунитета, фракционирования и идентификации иммуноцитов, метаболической активности фагоцитов и активности в них миелопероксидазы, а также НСТ-тестам, определению классов иммуноглобулинов, ЦИК (циркулирующий иммунный комплекс), РБТЛ (реакция бласттрансформации лимфоцитов) и РТМЛ (реакция торможения миграции лимфоцитов). Дается доступное представление о методах полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА), определения цитокинов — медиаторов межклеточного взаимодействия в иммунном ответе методом ИФА.
Издание много внимания уделяет самостоятельной подготовке студентов по представленному материалу. В конце учебника по всем представленным темам ЛПЗ для лучшего освоения изучаемого материала предлагаются вопросы и ответы для тестового контроля знаний. С целью облегчения восприятия специальной терминологии приведен терминологический словарь.
Лучшему освоению материалов, выносимых на самостоятельное изучение, будут способствовать данные в заключительной части учебника четыре приложения:
1) «Превращение микроорганизмами соединений углерода» — включает темы молочно- и маслянокислого, а также спиртового брожения;
2) «Превращение микроорганизмами соединений азота» — содержит темы, касающиеся процессов азотфиксации, аммонификации, нитрификации и денитрификации;
3) «Рецепты приготовления красителей и индикаторов»;
4) «Рецепты приготовления растворов».
Все включенные в практикум темы и приложения изложены по общей схеме: цель занятия, материалы и оборудование, теоретические сведения, методический материал для выполнения работы, задания для самостоятельной работы, вопросы для самоконтроля знаний.
Практикум составлен в классическом стиле, для наглядности иллюстрирован фотоматериалами (в виде цветных и черно-белых фотографий, электроннограмм) и таблицами с краткими сводками по ключевым аспектам микробиологии и иммунологии.
Необходимость подобного практикума очевидна. Она вытекает из потребностей смежных наук (физиология, биохимия, зоогигиена, генетика, акушерство, ВСЭ, патологическая анатомия, экология) и другие дисциплины, для которых знания по микробиологии и иммунологии при подготовке магистра/бакалавра в области ветеринарно-санитарной экспертизы являются базовыми.
Надеемся, что учебник удовлетворит запросы студентов, аспирантов, преподавателей, научных сотрудников, а также всех, кто сочтет представленные в нем материалы нужными и полезными.
Автор выражает искреннюю признательность рецензентам за ценные замечания и пожелания по улучшению практикума и всем тем, кто проявил интерес и оказал помощь в его подготовке.
Замечания и пожелания к изданию можно присылать по адресу: 126434, г. Москва, ул. Тимирязевская, 49, Российский государственный аграрный университет — МСХА имени К. А. Тимирязева, кафедра микробиологии и иммунологии, Маннаповой Р. Т.
Список сокращений
АГ — антиген
АМФ — альвеолярные макрофаги
АПК — антигенпрезентирующая клетка
АТ — антитело
БГКП — бактерии группы кишечной палочки
БЦЖ — вакцина Кальметта—Герена
ВГНКИ — Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов
ГАС — генерализованный адаптационный синдром
ГЗТ — гиперчувствительность замедленного типа
Г-КСФ — гранулоцитарный колониестимулирующий фактор
ГМ—КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор
ДПН — дифосфопиридиннуклеотид
Е-РОК — метод «спонтанных розеток»
ЕАС—РОК — метод розеткообразования
ЖСА — желточно-солевой агар
ИД — инфекционная доза
ИФА — иммуноферментный анализ
ИЛ — интерлейкин
ИЭФ — иммуноэлектрофорез
КАМ — комплементный антиген из атипичных микобактерий
ККРНГА — кровекапельная реакция непрямой гемагглютинации
КСФ — колониестимулирующий фактор
КР — кольцевая реакция агглютинации с молоком
КУА — казеиново-угольный агар
ЛД — летальная доза
ЛТФ-130 — лиофилизированная вакцина против трихофитии крупного рогатого скота
МАФАМ — мезофильные аэробные и факультативно-анаэробные микробы
МАС — местный адаптационный синдром
МБцК — минимальная бактерицидная концентрация
МПА — мясопептонный агар
МПБ — мясопептонный бульон
МПЖ — мясопептонный желатин
МПК — минимальная подавляющая концентрация
мРНК — матричная рибонуклеиновая кислота
МФА — метод флюоресцирующих антител
2-МЭ — 2 меркаптоэтанолом (для обработки сывороток)
НСТ-тест — тест с нитросиним титразолием
ОМЧ — общее микробное число
ПЖА — полужидкий мясопептонный агар
ПМФ — перитониальные макрофаги
ПЦР — полимеразная цепная реакция
РА — реакция агглютинации
РБП — проба с бенгальским розовым
РБТЛ — реакция бласттрансформации лимфоцитов
РДП — реакция диффузной преципитации
РИФ — реакция иммунной флюоресценции
РК — реакция Кумбса
РКП — реакция кольцепреципитации
РМА — реакция микроагглютинации
РН — реакция нейтрализации
РНГА — реакция непрямой гемагглютинации
РНК — рибонуклеиновая кислота
РП — реакция преципитации
рРНК — рибосомальная рибонуклеиновая кислота
РСК — реакция связывания комплемента
РТГА — реакция торможения гемагглютинации
РТПХ — реакция «трансплантат против хозяина»
СЖН — сафранино-железо-новобиоционовая среда
СПМ — санитарно-показательные микроорганизмы
тРНК — транспортная рибонуклеиновая кислота
ФНО — фактор некроза опухоли
ФСБР — фосфатно-солевой буферный раствор
ФЭВ — ферментативное экстрагенное вещество
ЦИК — циркулирующий иммунный комплекс
ЧБК — чистая бактериальная культура
BCR — рецептор В-лимфоцита
Ig — иммуноглобулин
MHC — главный комплекс гистосовместимости (Major Histocompatibility Complex, произносится «эм эйч си»)
NK — естественный киллер (от англ. natural killer)
pH — концентрация водородных ионов
TCR — рецептор Т-лимфоцитов
Раздел I. Общая микробиология: морфология и физиология микроорганизмов
Тема 1. Знакомство с микробиологической лабораторией. Техника безопасности при работе в микробиологической лаборатории. Оптическая и иммерсионная системы микроскопа. Морфология микроорганизмов
1.1. Цель занятия
Ознакомиться с правилами работы в микробиологической лаборатории. Усвоить технику безопасности и личной профилактики. Освоить правила работы со световым, люминесцентным и электронным микроскопами и особенности иммерсионной системы. Изучить основные формы и разнообразие бактерий.
1.2. Материалы и оборудование
Микроскопы, окрашенные микроскопические препараты для ознакомления с разнообразием форм микробов, штативы, сливные чашки с мостиками, пробирки, красители, бактериологические петли, пастеровские пипетки, песочные часы, колбы с дистиллированной водой, банки с дезинфицирующими растворами для отработанных препаратов, иммерсионное масло, салфетки для снятия иммерсионного масла с объектива. Мультимедийное устройство, презентация и таблицы по теме.
1.3. Теоретический материал
1.3.1. Основная задача ветеринарных бактериологических лабораторий
Основная задача — диагностика болезней сельскохозяйственных животных, пушных зверей, птиц, рыб, пчел, а также проведение санитарной экспертизы сырья и продуктов животного происхождения, других пищевых продуктов, кормов.
Бактериологические лаборатории размещают вдали от проезжих дорог в специализированном здании. В лаборатории предусматривают приемное отделение, бактериологический, вирусологический, серологический, биохимический, токсико-микологический и патологоанатомический отделы, помещения для бокса (для выполнения работы в стерильных условиях), для термостатов, стерилизации посуды и питательных сред, для мытья посуды, весовую, складские помещения. Имеется здесь и виварий для содержания лабораторных животных. Предусматриваются также кабинет заведующего, раздевалки, комнаты для специалистов, обслуживающего персонала, помещения для библиотеки и др.
В моечной комнате должны быть металлические столы, раковины, газовые или электрические плиты, шкафы (вытяжной, сушильный) и др. Наличие вытяжного шкафа необходимо для удаления паров воды и некоторых реактивов, используемых при мойке посуды. Полы и стены полагается облицовывать плиткой.
В комнате для стерилизации размещают автоклавы, печи Пастера, аппараты Коха, столы. Она должна хорошо вентилироваться. Пар из автоклава до подъема давления выводят через резиновую трубку во внешнюю среду. Дверь (без стекла) и окна должны открываться наружу.
Комната для приготовления питательных сред должна быть облицована плиткой, пол выстлан плиткой или покрыт линолеумом. В этой комнате размещаются газовая или электрическая плита, холодильник, столы, шкафы, ящики с отсеками для сред, компонентов сред.
В термостатной комнате размещают термостаты. Они бывают разных форм и размеров. Температура в термостате обычно составляет для культивирования плесневых грибов 20–35 °С, многих сапрофитов — 25–30 °С, возбудителей инфекционных болезней — 35–37 °С, термофилов — 40–45 °С.
Препараторская — помещение для подготовки оснащения и исследуемого материала к лабораторно-практическим занятиям.
Бокс — комната, в которой осуществляются посевы и пересевы культур микроорганизмов в стерильных условиях. Он герметично застеклен, имеет предбоксник с раздвижной дверью. Стены бокса должны быть облицованы плиткой или окрашены белой масляной краской, пол — покрыт плиткой или линолеумом. Уборку в боксе производят с применением дезинфицирующих средств (3–5%-ным раствором фенола, 2–3%-ным раствором натрия гидрокарбоната). В боксе устанавливаются бактерицидные лампы (БУВ-15, БУВ-30 и др.). Стерилизацию воздуха осуществляют от 30 мин до нескольких часов, в зависимости от степени загрязненности. Ультрафиолетовые лучи вызывают острое воспаление роговицы глаз, поэтому нельзя находиться в комнате с включенной бактерицидной лампой или необходимо пользоваться специальными защитными очками.
В виварии содержат лабораторных животных: белых мышей, белых крыс, морских свинок, а также кроликов барана-донора.
Реактивы и некоторые биологические препараты при необходимости хранят в специально отведенном подвальном помещении или темном сухом стенном шкафу при невысокой температуре.
1.3.2. Правила работы и техника безопасности в ветеринарных бактериологических лабораториях
1. В помещение входить только в халате и белой шапочке.
2. Нельзя вносить в лабораторию посторонние вещи, продукты.
3. В помещении лаборатории запрещается пить, принимать пищу.
4. Перед началом работы о замеченных недостатках, неисправностях приборов, горелок, посуды студенты сообщают преподавателю или лаборанту.
5. Запрещается зажигать одну горелку от другой.
6. Нельзя касаться проводов и контактных частей электросети металлическими и другими предметами. Не включать любую электроаппаратуру без разрешения преподавателя или лаборанта.
7. Любой используемый для учебных занятий материал должен рассматриваться как особо опасный.
8. При работе с бактериологическим материалом придерживаются общепринятых правил, исключающих возможность инфицирования.
9. В ходе распаковки любого присланного для исследования материала необходимо соблюдать осторожность (банки снаружи обтирать ватой, смоченной дезинфицирующим раствором, ставить только на подносы).
10. При работе с жидким инфицированным материалом используют резиновые баллоны с пипеткой. Инфицированные жидкости переливают над посудой с дезинфицирующим раствором.
11. Вскрытие трупов лабораторных животных производят в специальных халатах, на оборудованном столе, с помощью необходимых инструментов, используя кювету, залитую парафином. Инструменты после работы помещают в стакан с дезраствором или обжигают на пламени горелки. Нельзя класть на стол!
12. В случае случайного попадания патологического материала на стол его немедленно удаляют тампоном с дезинфицирующим раствором. При попадании материала на кожу, конъюнктиву, слизистую ротовой полости принимают срочные меры к обеззараживанию.
13. По окончании работы патологический материал, культуры микроорганизмов, поверхность стола, инструменты подвергают обеззараживанию. Материал, использованный в работе, в конце занятия студенты сдают преподавателю, а рабочее место приводят в порядок.
14. Перед уходом из лаборатории необходимо снять халат, вымыть руки и обработать их 70-градусным этиловым спиртом.
1.3.3. Устройство светового микроскопа и работа с ним
Микроскоп — оптический прибор для исследования объектов, невидимых невооруженным глазом. В световом микроскопе различают механическую и оптическую части.
К механической части относятся: подошва (основание), предметный столик, тубус, тубусодержатель, конденсор с ирисовой диафрагмой, макрометрический винт, микрометрический винт, винт конденсора, «револьвер» (узел смены объективов). К оптической части — зеркало, или осветительное устройство (источник света, зеркало), окуляр, объективы.
Подошва обычно цельнометаллическая с прямоугольной (подковообразной) ножкой для обеспечения устойчивости микроскопа. Она соединена с коробкой с механизмом микрометрической фокусировки.
Предметный столик по форме может быть прямоугольным или круглым. На нем закреплены клеммы-зажимы для фиксации предметных стекол или препаратоводитель (в современных микроскопах). При отсутствии препаратоводителя по краям предметного столика вставлены центровочные винты для перемещения столика.
С другой стороны коробки с помощью кремальеров прикреплен тубусодержатель, в верхней части которого расположен «револьвер», состоящий из двух пластин и соединенный с тубусом. Верхняя пластинка закреплена неподвижно, а нижняя имеет гнезда для ввинчивания объективов; она вращается.
Тубус может быть прямым или наклонным. В верхнюю часть тубуса вставляется окуляр. Передвижение тубусодержателя осуществляется с помощью винтов. Макрометрический винт служит для нахождения объекта на препарате путем грубой наводки, а микрометрический — для установления четкости изображения. Полный оборот микровинта поднимает или отпускает тубусодержатель на 0,1 мм.
На барабане микрометрического винта имеется 50 делений (каждое деление соответствует перемещению системы на 2 мкм). Макрометрическая фокусировка состоит из системы зубчатых колес и рычага. Поэтому обращаться с винтом нужно аккуратно и не вращать до упора. При вращении рукояток макро- и микрометрического винтов по часовой стрелке тубус микроскопа опускается, против часовой стрелки — поднимается.
Зеркало или осветительное устройство необходимо для направления лучей света в микроскоп.
Объективы — система линз, закрепленных в металлической оправе (их количество доходит до 10). Передняя (фронтальная) линза — основная, самая малая, производит основное увеличение, остальные (коррекционные) исправляют искажения оптического изображения. Объективы делят на ахроматы и апохроматы. Ахроматы имеют дефект — хроматическую аберрацию, при которой происходит разложение света на составные части спектра. У апохроматов нет этого недостатка. Они имеют большое количество линз из стекла разного химического состава.
Различают сухие и иммерсионные (погруженные в масло или воду) системы объективов. При сухой системе между фронтальной линзой и рассматриваемым препаратом находится прослойка воздуха, а при работе с иммерсионным объективом на исследуемый мазок наносится иммерсионное масло, и объектив погружают в масло (чаще всего в кедровое, реже в касторовое, гвоздичное) или воду (при специальном объективе). Предметное стекло, на котором сделан препарат, и кедровое масло имеют почти одинаковые показатели преломления света (1,25 и 1,51 соответственно). Поэтому лучи, проходя из одной среды в другую, почти не преломляются, за счет чего при иммерсионной системе объектива создается большее увеличение, чем при сухой системе. Показатель преломления света касторового масла равен 1,48–1,49, гвоздичного — 1,53, смеси касторового и гвоздичного масел — 1,515. А показатели преломления света воздуха и стекла значительно отличаются: 1,0 и 1,52 соответственно.

Рис. 1.1. Строение светового микроскопа
Поэтому при сухой системе объектива регистрируются значительное преломление и потеря лучей света, а следовательно, меньшее увеличение исследуемого на препарате объекта.
В иммерсионных объективах отмечаются короткое фокусное расстояние и большое увеличение. Здесь расстояние между фронтальной линзой и препаратом невелико, поэтому пользоваться этой системой нужно аккуратно во избежание повреждения линзы и препарата. Иммерсионные объективы (х90) имеют пружинную оправу, что исключает повреждение фронтальной линзы и препарата при их соприкосновении. Обозначения сухих линз: ×8, ×20, ×40.
Окуляры (от лат. oculus — глаз) расположены в верхней части тубуса. Они заключены в металлическую оправу и состоят из двух плосковыпуклых линз, обращенных выпуклыми сторонами к объективу. Между линзами располагается металлическая диафрагма. Линза, обращенная к глазу, называется глазная, к объективу — собирательная (полевая). Короткие окуляры дают более сильное увеличение, длинные — слабое. В зависимости от этого окуляры обозначаются: ×7, ×10, ×15, ×20. Общая увеличивающая способность микроскопа равна произведению увеличения объектива на увеличение окуляра (при увеличении объектива ×90 и окуляра ×20 увеличение микроскопа равно 1800).
Разрешающая способность микроскопа — это величина, обратная тому наименьшему расстоянию, на котором могут быть видны раздельно два соседних элемента структуры. Это одна из важных характеристик микроскопов, в том числе электронных. Самая высокая разрешающая способность у просвечивающих микроскопов. Они превосходят по этому параметру световые микроскопы в несколько тысяч раз. Высокое разрешение у электронных микроскопов достигается очень малой длиной волны электронов. Чем короче длина волны источника излучения, тем выше разрешающая способность микроскопа. Она составляет 1350 (90×15).
Осветительный аппарат состоит их трех элементов — конденсора Аббе, диафрагмы и зеркала. Конденсор Аббе имеет две линзы, заключенные в металлическую оправу. Он собирает лучи света, идущие от зеркала, в один мощный пучок. Ирисовая диафрагма служит для регулирования пучка света, то есть освещения препарата путем ее сужения или расширения с помощью специального винта. Поэтому окрашенные препараты, частично задерживающие свет, лучше изучать при открытой диафрагме; неокрашенные препараты (висячую или придавленную каплю) — с полуоткрытой диафрагмой (в слабом пучке света). Это дает возможность увеличивать контрастность неокрашенных форм микробов. В микроскопах серии «Биолам» вставлена дополнительная откидная линза в оправе. Ее необходимо использовать при работе с объективами малого увеличения. Плоское зеркало применяется при хорошем естественном освещении в микрофотосъемках, вогнутое — при искусственном и слабом естественном освещении.
Микроскоп МБИ-1 имеет наклонный и вертикальный тубусы. Наклонным тубусом исследуют объекты на горизонтальной поверхности предметного столика. Макро- и микрометрический винты находятся в нижней части штатива. При их вращении руки лежат на столе, и длительная работа не вызывает усталости. Бинокулярные микроскопы МБР-3, «Биолам» и другие имеют два наклонных тубуса, что позволяет рассматривать препарат обоими глазами.
Эти микроскопы дают плоское увеличение. В настоящее время применяются объемные микроскопы, которые позволяют рассматривать исследуемый объект в трех измерениях. Это достигается путем смены фокусного расстояния 50 раз в минуту, создавая оптическое впечатление объемности.
В проекционных микроскопах большое значение имеет освещенность препаратов. Чем она выше, тем лучше видимость. К ним относится лазерный микроскоп с мощным усилителем света, который в отличие от других подобных источников не разрушает биологические объекты и позволяет проецировать изображение на экран.
1.3.4. Работа с иммерсионной системой
Объективы малого увеличения (×3,5, ×8, ×9) используют для предварительного осмотра препарата, объективы среднего увеличения (×20, ×40) — для изучения крупных клеток микроорганизмов (например, грибов). Эти объективы называются сухими, поскольку при микроскопии между фронтальной линзой и препаратом находится воздух. При этом благодаря различию показателей преломления воздуха (n = 1) и стекла (n = 1,52) часть лучей, освещающих препарат, рассеивается и не попадает в объектив.
Объективы больших увеличений (×85, ×90) — иммерсионные. При работе с ними необходима максимальная освещенность препарата. Устранение рассеивания, неизбежного при работе с сухими объективами, в данном случае достигается путем использования иммерсионных жидкостей, у которых показатель преломления близок к показателю преломления стекла (рис. 1.2).
Вначале под малым увеличением микроскопа наводят свет и определяют на препарате участок микроскопирования. Затем на выбранное место наносят каплю кедрового масла и осторожно (под контролем глаз с боку) погружают в нее фронтальную линзу иммерсионного объектива (×90).
По окончании работы объектив поднимают, убирают препарат, а с фронтальной линзы кусочком фильтровальной бумаги убирают остатки масла. Иммерсионные объективы имеют короткое фокусное расстояние (до 2,3 мм), поэтому наводить на резкость следует путем поднимания объектива, а не опускания его, так как при небольшом рабочем расстоянии можно раздавить препарат и повредить фронтальную линзу. После грубой наводки, которую выполняют с помощью макрометрического винта, руки переводят на микрометрический винт и осуществляют более точную фокусировку.

Рис. 1.2. Схема лучей в иммерсионной системе: 1 — объектив микроскопа; 2 — предметное стекло; 3 — объект исследования;4 — иммерсионное масло; 5 — лучи света; 6 — фронтальная линза объектива
1.3.5. Морфология микроорганизмов
По форме бактерии делят на три основные группы — шаровидные (кокки), палочковидные и извитые (рис. 1.3).
Шаровидные (кокки). В эту группу входят в основном факультативно анаэробные, редко подвижные, не образующие спор микробы. Кокки являются грамположительными микробами. В зависимости от расположения клеток после деления подразделяются на:
• микрококки — кокки, расположенные единично или беспорядочно, их диаметр не превышает 0,5 мкм. В эту группу входят сапрофиты, обитатели воды, воздуха;
• диплококки — кокки, которые делятся в одной плоскости, как результат деления одной особи, и располагаются попарно. Они неподвижны, не образуют спор.
Имеются сапрофитные формы (в почве, водоемах), а также патогенные — пневмококки, менингококки и др.
Стрептококки — (гр. streptos — цепочка) делятся в одной плоскости, и образующиеся клетки не разъединяются, располагаясь в цепочки разной длины. Грамположительные, не образуют спор. Их делят на патогенные — возбудители многих инфекционных болезней, фекальные (энтерококки) — обитатели кишечника; молочнокислые — встречаются на различных растениях, в молоке, используются для получения молочнокислых продуктов.
Стафилококки — (гр. staphilиs — гроздь) делятся в разных плоскостях, образуя беспорядочные скопления клеток, иногда напоминающие грозди винограда. Это грамположительные факультативные анаэробы, не образующие спор. Являются возбудителями (чаще S. aureus) различных гнойно-воспалительных процессов (абсцессов, флегмон, фурункулов, карбункулов, остеомиелитов, гнойных плевритов, ангин, сепсиса, маститов и др.), пищевых токсикоинфекций и т.д.
Тетракокки — кокки, располагаются по четыре, деление у них происходит в двух взаимно перпендикулярных плоскостях.
Сарцины (гр. sarcio — соединяю) — кокки, соединенные в виде пакетов в результате деления клеток в трех взаимно перпендикулярных плоскостях. Среди них болезнетворных видов не обнаружено.
Тетракокки и сарцины в основном почвенные микроорганизмы.
Палочковидные бактерии. Самая многочисленная и разнообразная группа. Палочковидные микроорганизмы подразделяются на бактерии, бациллы и клостридии. Их размеры колеблются от нескольких долей микрометра до 10–15 мкм и более. Различают короткие, длинные, тонкие и толстые палочки. Концы у них могут быть закруглены или резко обрублены. Некоторые палочковидные бактерии имеют разветвленную (микобактерии) или овоидную форму, характерную для пастерелл. Они могут располагаться одиночно или беспорядочно, группироваться попарно (диплобактерии, стрептобациллы). Встречаются как сапрофитные, так и патогенные виды.
Бактерии — имеют цилиндрическую форму и не образуют спор (например, возбудители туберкулеза, бруцеллеза, рожи свиней, листериоза).
Различают палочковидные формы бактерии, которые образуют споры. Среди спорообразующих существуют собственно бациллы и клостридии.

Рис. 1.3. Основные формы бактерий: а — микрококки; б, в — диплококки; г — стрептококки; д — стафилококки; е — тетракокки; ж — сарцины; з, и, к — палочки; л — вибрионы; м — спириллы
Бациллы — спорообразующие палочки, по типу дыхания аэробы, т.е. для своего развития нуждаются в свободном молекулярном кислороде. Грамположительные, образующие при неблагоприятных условиях (вне организма) споры. Диаметр споры меньше ширины клетки. Большинство из них сапрофиты, некоторые служат возбудителями болезней (напр. Bac. аntracis — возбудитель сибирской язвы).
Клостридии — спорообразующие палочки, по типу дыхания анаэробы, диаметр споры превышает ширину микробной клетки. Поэтому в процессе спорообразования клостридии изменяют свою конфигурацию.
Термин «клостридии» происходит от греческого слова closter — веретено. Они являются возбудителями клостридиозов: эмфизематозного карбункула, злокачественного отека, брадзота, столбняка, ботулизма и др.
Извитые формы. Это тонкие бактерии, тело которых спиралевидно изогнуто. Извитые бактерии разделяются на вибрионы, спириллы и спирохеты. По величине они бывают крупными (более 5 мкм), средними (1–4 мкм) и мелкими (0,5 мкм).
Вибрионы — имеют форму запятой, поворот тела вокруг оси не превышает четверти оборота. Они могут встречаться в различных таксономических группах (возбудители кампилобактериоза сельскохозяйственных животных и холеры человека).
Спириллы — характеризуются небольшим числом крупных завитков (1–3). Передвигаются с помощью жгутиков. Грамотрицательные, подвижные, факультативные — аэробы.
Спирохеты — имеют штопорообразную форму с большим количеством завитков. Грамотрицательные, обладают активной подвижностью. На конце тела имеются жгутики, расположенные в виде пучка.
1.4. Задания для самостоятельной работы
Задание 1. Ознакомиться с бактериологической лабораторией, основным оборудованием бактериологических отделов ветеринарных лабораторий, правилами техники безопасности при работе в бактериологических лабораториях.
Задание 2. Изучить устройство светового микроскопа, ознакомиться с принципами иммерсионной и темнопольной микроскопии.
Задание 3. Провести микроскопию готовых окрашенных препаратов, определить и зарисовать основные формы микроорганизмов.
1.5. Вопросы для самоконтроля знаний
1. Основные задачи ветеринарных бактериологических лабораторий.
2. Основные отделения ветеринарных лабораторий, принцип их устройства, оснащения оборудованием.
3. Принцип работы с иммерсионной системой микроскопа.
4. Какие различают основные морфологические признаки бактерий?
5. Каковы основные правила работы в микробиологической лаборатории?
6. Какие части микроскопа относятся к оптическим? Дайте им характеристику. Как определяется общая увеличивающая способность микроскопа?
7. Какими составными частями представлен осветительный аппарат и каково их назначение?
8. Каковы назначения и правила работы с макро- и микрометрическими винтами?
9. Каковы особенности работы при люминесцентной микроскопии?
10. Какие вы знаете группы шаровидных бактерий в зависимости от их расположения?
11. На чем основано деление бактерий на собственно бактерии, бациллы и клостридии?
12. Какие морфологические группы имеются среди извитых форм?
Тема 2. Приготовление, фиксация и окраска препаратов. Микробиологические краски. Простые и сложные методы окрашивания микроорганизмов (по Граму, по Цилю–Нельсену)
2.1. Цель занятия
Ознакомиться с техникой приготовления препарата для микроскопии из культуры микробов. Приготовить, окрасить препарат простым методом и зарисовать в рабочей тетради разные формы микробов. Отработать методику сложных методов окраски (по Граму, по Цилю — Нельсену).
2.2. Материалы и оборудование
Микроскопы, растворы красок, пробирки с культурами микробов, спирт этиловый 96°, дистиллированная вода, предметные стекла, бактериологические петли, пинцеты, фильтровальные бумаги, сливные чашки, мостики, карандаши или чернила по стеклу, песочные или другие часы, горелки (спиртовки), спички, кедровое масло, готовые окрашенные препараты с разными формами микробов. Мультимедийное устройство, презентация и таблицы по теме.
2.3. Теоретический материал
2.3.1. Приготовление препаратов
Для обнаружения и изучения тинкториально-морфологических свойств микроорганизмов необходимо приготовить препараты из исследуемого материала, окрасить их и изучить под микроскопом.
Препараты готовят на предметных стеклах. Материалом служат взвеси бактериальных культур, выросших на питательных средах, мясо, молоко. Из них готовят препараты-мазки, а из тканей и органов — препараты-отпечатки.
Предметные стекла должны быть чистыми, хорошо обезжиренными. Их хранят в банках с притертыми пробками в смеси 1:1 этилового спирта и эфира или в 96-градусном этиловом спирте.
Препараты готовят с помощью бактериологической петли или пастеровской пипетки.
Порядок приготовления препарата для микроскопии: обезжиривание предметного стекла, приготовление мазка, высушивание его на воздухе, фиксация и окраска мазка.
Обезжиривание предметного стекла. Новые предметные стекла сначала моют в воде, потом помещают в смесь спирта и эфира фламбируют над пламенем горелки (обезжиривают). Также новые предметные стекла можно готовить кипячением в течение 10 мин в 1%-ном растворе натрия гидрокарбоната (соды), с последующим промыванием в дистиллированной воде с добавлением 0,5% соляной кислоты (для нейтрализации) и окончательным споласкиванием в дистиллированной воде.
Приготовление мазка. С целью приготовления препарата — мазка из бульонной культуры на предметное стекло бактериальной петлей наносят исследуемый материал и равномерно распределяют в пределах предварительно начерченной границы мазка. Препарат высушивают на воздухе и фиксируют.
С помощью стерильных пастеровских пипеток готовят препараты-мазки из жидкостей и бульонных культур. Для этого заранее над пламенем горелки отламывают запаянный конец пипетки и набирают материал. Каплю исследуемого материала наносят на предметное стекло, распределяют пипеткой в пределах начерченной границы. Затем пастеровскую пипетку помещают в сосуд с дезинфицирующим раствором. Высушивание готовых препаратов проводят при комнатной температуре.
Для приготовления препарата-мазка из бактериальной культуры, выращенной на плотной питательной среде, с помощью бактериальной петли на предметное стекло наносят небольшую каплю стерильного физиологического раствора. Затем петлю фламбируют (стерилизуют над пламенем горелки в вертикальном положении). Из пробирки с культурой микробов мизинцем и ладонью правой руки вынимают пробку (рис. 2.1).
Пробирку с культурой микробов необходимо держать левой рукой пробкой к себе. Затем вынимают пробку, обжигают края пробирки и вносят в нее бактериологическую петлю. Ее охлаждают, касаясь стенок пробирки, и только потом забирают материал. Петлю с бактериальной культурой вынимают осторожно, не касаясь края пробирки; материал вносят в приготовленную ранее каплю физраствора, размешивают в ней и равномерно распределяют по стеклу в пределах границы мазка в виде небольшого овала или круга. По окончании приготовления мазка бактериальную петлю вновь прокаливают над пламенем горелки.
Фиксация мазка. Фиксацию мазка проводят физическим и химическим способами.
Физический способ фиксации — над пламенем горелки. При этом методе предметное стекло с мазком берут большим и указательным пальцами или пинцетом, проводят три-четыре раза над пламенем горелки, каждый раз прикладывая стекло к коже руки. Ощущение легкого жжения свидетельствует о том, что мазок фиксирован. При этом способе фиксации микробы погибают и плотно прикрепляются к стеклу.
Химический способ фиксации мазков применяется при исследовании крови и мазков-отпечатков из тканей и органов, так как под влиянием высоких температур разрушаются клетки. Для этого препараты погружают в фиксирующую жидкость: в этиловый спирт — на 10 мин, в смесь Никифорова (спирт плюс эфир, 1:1) — на 15 мин, в метиловый спирт — на 5 мин, в ацетон — на 5 мин.
Цель фиксации: а) убить микробы; б) закрепить их на стекле; в) убитые микробы вследствие коагулирования белка клетки лучше окрашиваются.
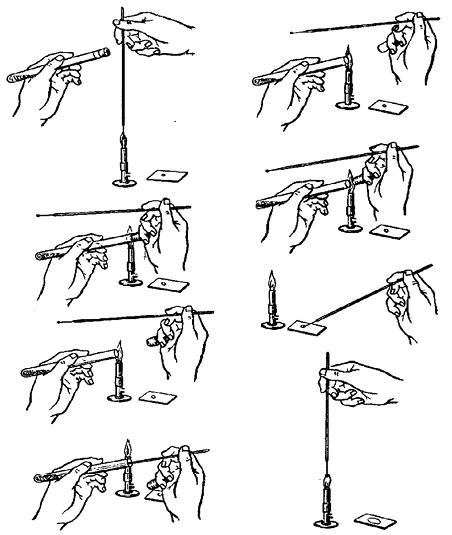
Рис. 2.1. Схема приготовления препарата-мазка
2.3.2 Окраска мазка
Для окрашивания микробов используют анилиновые красители. Чаще всего употребляют следующие красители: красные — фуксин, сафранин, нейтральрот; синие — метиловый, опаловый или водный синий; фиолетовые — метилвиолет, кристаллвиолет, генцианвиолет; зеленые — малахитовая или бриллиантовая зелень; коричневые — хризоидин, везувин; черная — нигрозин.
При простом методе окрашивания применяется только один краситель, чаще всего это фуксин или метиленовая синь. На охлажденный фиксированный мазок наносят раствор краски, выдерживают 3–5 мин, затем краску смывают, мазок промывают водой, высушивают фильтровальной бумагой и микроскопируют под иммерсионной системой микроскопа. Этот способ окраски позволяет определить наличие микробов в исследуемом материале, установить их форму и взаиморасположение.
Для сложных способах окрашивания требуются растворы нескольких красок и реактивов. Они основаны на физико-химических различиях состава бактерий. Сложные способы позволяют: определить морфологию микробов, установить их тинкториальные особенности (разное окрашивание при использовании специальных методов), наличие или отсутствие структурных элементов клетки (капсула, спора) и др. Это специальные методы исследований. К сложным способам окрашивания относятся: окраска по Граму (дифференцирует микробы на грамположительные и грамотрицательные), по Цилю –Нельсену (на микобактерии туберкулеза), по Козловскому (на бруцеллез), по Михину и по Ольту (на капсулы), по Златогорову и Пешкову (на споры).
2.3.3. Окраска по Граму
Метод Грама (модификация по Синеву). Этот метод позволяет разделить все микроорганизмы на две группы: грамположительные (Гр+) и грамотрицательные (Гр–).
На фиксированный мазок помещают:
1.Кусочек фильтровальной бумаги, пропитанной 1%-ным спиртовым раствором генцианвиолета, наносят 2–3 капли воды и окрашивают 2–3 мин. Затем снимают бумагу, мазок не смывают. На этом этапе все микробы на препарате окрашиваются в фиолетовый цвет.
2.Наносят раствор Люголя на 2 мин, смывают водой. Раствор Люголя содержит йод, который фиксирует фиолетовое окрашивание Гр+ микробов.
3.Обрабатывают 96-градусным этиловым спиртом, выдерживают в течение 20–30 с и тщательно смывают мазок водой. Спирт обесцвечивает за такое короткое время Гр- микробы.
4.Докрашивают мазок фуксином в течение 2–3 мин и смывают водой.Грамотрицательные окрашиваются в розовый цвет.
5.Высушивают на воздухе и микроскопируют.
Микроскопическая картина: грамположительные микробы фиолетового цвета, а грамотрицательные — розового (рис. 2.2, а).
Окраска микроорганизмов по этому методу зависит от химического состава клеточной стенки (наличие муреина и частично липида) и цитоплазмы, pH среды, от различия в строении бактериальной стенки у Гр+ и Гр– микробов.
2.3.4. Окраска по Цилю — Нельсену
На фиксированный мазок наносят небольшой кусок фильтровальной бумаги, на него — раствор карболового фуксина. Снизу препарат подогревают над пламенем горелки до появления паров и оставляют на «мостике» 5–7 мин. Затем краску с бумагой убирают (не промывая). Наносят 3–5%-ный раствор серной кислоты, окрашивают 5–7 мин, хорошо промывают водой. Затем добавляют раствор метиленовой сини (по Леффлеру), окрашивают 4–5 мин. Препарат промывают водой и высушивают фильтровальной бумагой.
Микроскопическая картина: кислотоспиртоустойчивые бактерии окрашиваются в красный цвет (не обесцвечиваются кислотой), некислотоустойчивые — в синий (первоначально окрасившись фуксином в красный цвет, легко обесцвечиваются кислотой и воспринимают дополнительную окраску метиленовой сини) — рис. 2.2, б.

Рис. 2.2. а — окраска по Граму; б — окраска по Цилю — Нельсену
2.4. Задания для самостоятельной работы
Задание 1. Приготовить препараты бактерий из бульонных и агаровых культур микробов.
Задание 2. Окрасить готовые препараты простым методом (фуксином или метиленовой синькой), по Граму, по Цилю — Нельсену, зарисовать.
2.5. Вопросы для самоконтроля знаний
1.Какие красители применяются в микробиологии?
2.Какие имеются способы фиксации? В чем состоит цель фиксации?
3.Какова последовательность приготовления препарата для микроскопии?
4.В чем особенность простого метода окрашивания? Что позволяет установить простой способ окрашивания?
5.Как проводится обработка предметных и покровных стекол для приготовления препарата?
6.Какие существуют методы фиксации? Почему применяют разные методы фиксации мазка?
7.Чем обусловлено разное окрашивание бактерий по Граму?
8.Каково действие спирта при окрашивании по Граму?
9.Какова особенность окраски по Цилю – Нельсену?
10.При диагностике каких заболеваний применяется окраска на споры, капсулы по Граму и по Цилю — Нельсену?
Тема 3. Методы окрашивания спор и капсул. Исследование бактерий на подвижность
3.1. Цель занятия
Освоить методы окрашивания препаратов на капсулы и споры. Приготовить, окрасить препараты по Златогорову на споры. Освоить методы определения подвижности микроорганизмов на препаратах придавленная и висячая капля. Зарисовать в рабочих тетрадях полученные результаты.
3.2. Материалы и оборудование
Микроскопы, растворы красок, спирт этиловый 96-градусный, предметные стекла, бактериологические петли, пробирки с культурами микробов, сливные чашки, дистиллированная вода, фильтровальная бумага, пинцеты, мостики, карандаши по стеклу, или маркеры, часы, горелки (спиртовки), спички, кедровое масло, окрашенные препараты на капсулы, мультимедийное устройство, презентация и таблицы по теме.
3.3. Теоретический материал
3.3.1. Окраска спор.
Существует несколько методов окрашивания на споры. Все они включают три основных этапа: прокрашивание споры концентрированными растворами красок, обесцвечивание вегетативной части клетки, докрашивание вегетативной части клетки.
Окраска спор по Златогорову. 1. На фиксированный мазок наносят карболовый фуксин, окрашивают 5–10 мин. Происходит прокрашивание споры. На этом этапе спора и вегетативная часть клетки приобретают красный цвет.
2. Наносят 2%-ный раствор серной кислоты, выдерживают 2–3 с. Происходит обесцвечивание вегетативной части клетки, споры остаются красными.
3. Затем наносят раствор метиленовой сини, окрашивают 3–5 мин. Вегетативная часть клетки приобретают синий цвет
Микроскопическая картина: споры красного цвета, вегетативные формы — синие (рис. 3.1, а).

Рис. 3.1. а — окраска спор по Златогорову; б — окраска капсул по Михину
3.3.2. Окраска капсул
Капсула — толстый слизистый слой вокруг бактериальной клетки, муциноподобное вещество, высокомолекулярный полисахарид, который синтезируется в цитоплазме и секретируется на поверхности клеточной стенки.
Только сильно патогенные микроорганизмы образуют капсулу в инфицированном организме. Она является фактором вирулентности и защищает бактериальную клетку от фагоцитоза и от антител. Размеры их превышают тело микробной клетки. По химическому составу у одних видов микробов капсулы состоят из комплекса белков, у других — полисахаридов. Капсула и сама микробная клетка имеют разный химический состав, поэтому при окрашивании одной краской они приобретают разные цвета (сама бактериальная клетка красится в цвет применяемой краски, капсула приобретает какой-либо оттенок).
Правила окрашивания капсул:
1. Капсула быстро лизируется, поэтому материал должен быть свежим.
2. Мазок фиксируют химическим методом.
3. Для окрашивания используют метахроматические краски.
4. Препарат следует быстро промыть водой.
Окраска капсул по Ольту. На фиксированный мазок наносят:
• 2%-ный раствор сафранина (лучше свежий), окрашивают 5–7 мин;
• быстро смывают водой и высушивают.
Микроскопическая картина: тело микробной клетки окрашивается в кирпично-красный цвет, капсула — в желтый.
Окраска капсул по Михину. На фиксированный мазок наносят:
• метиленовый голубой Леффлера, окрашивают 2–3 мин при подогревании;
• быстро смывают водой и высушивают.
Микроскопическая картина: вегетативное тело микробной клетки окрашивается в синий цвет, капсула приобретает розовый оттенок (рис. 3.1, б).
3.3.3. Определение подвижности микроорганизмов
У микробов различают пассивное и активное движение. Пассивное — передвижение с частичками пыли, с водой, с воздухом, на теле человека и животных, с транспортом. Активное движение — за счет жгутиков. Жгутики бывают разной длины. Их диаметр очень мал (менее 0,2 мкм), и они невидимы в световом микроскопе. Жгутики исследуют в неокрашенных препаратах для наблюдения за движением микробов. В зависимости от расположения и количества жгутиков микроорганизмы делят на:
а) монотрихи — имеют один жгутик на одном конце. Совершают умеренные поступательные движения (псевдомонас);
б) лофотрихи — содержат несколько или множество (пучок) жгутиков на одном конце. Совершают активные поступательные движения (листерии). Обладают самой большой скоростью движения;
в) амфитрихи — жгутики расположены по одному или по несколько (возможен пучок) на обоих полюсах микробной клетки. Микробы передвигаются путем передергиваний то в одну, то в другую сторону;
г) перитрихи — жгутики расположены по всей поверхности микробной клетки, передвигаются беспорядочно, переворачиваются, кувыркаются (кишечная палочка).
Для изучения подвижности исследуют суточные культуры микробов. Старые культуры утрачивают способность передвигаться. Для исследования подвижности микробов готовят препараты «висячая капля» и «придавленная капля».
Приготовление препарата «висячая капля». Препарат готовят на предметном стекле с луночкой (углублением). Края луночки смазывают вазелином. На покровное стекло наносят каплю культуры из жидкой среды. Если культура выращена на плотной питательной среде, то на покровное стекло наносят каплю физиологического раствора, а затем перемешивают в ней культуру бактерий. Предметное стекло переворачивают и аккуратно опускают на покровное стекло, чтобы капля оказалась в центре углубления. Затем предметное стекло возвращают в прежнее положение. На препарате капля остается в закрытой влажной камере, подвешенной на внутренней поверхности покровного стекла. Для увеличения контрастности препарат исследуют в затемненном поле.

Рис. 3.2. Типы расположения жгутиков у бактерий
Приготовление препарата «придавленная капля». Каплю бактериальной культуры наносят на предметное стекло, накрывают покровным стеклом, слегка придавливают пальцем и микроскопируют.
3.4. Задания для самостоятельной работы
Задание 1. Приготовить препараты бактерий из бульонных и агаровых культур микробов.
Задание 2. Окрасить препараты на споры по методу Златогорова, зарисовать.
Задание 3. Изучить подвижность культур бактерий на препаратах «висячая» и «придавленная» капля.
3.5. Вопросы для самоконтроля знаний
1. Какова особенность окраски препаратов на споры?
2. Что такое спора? При каких условиях микробы образуют споры?
3. Какие вы знаете методы окрашивания капсул?
4. Что представляет собой капсула? Где и почему микробы образуют капсулу? Какие микробы образуют капсулу?
5. Какие различают микроорганизмы на основании расположения жгутиков?
6. Как микроорганизмы исследуют на подвижность?
7. Как осуществляется процесс образования спор у микробов?
Тема 4. Питательные среды для культивирования микроорганизмов. Приготовление основных питательных сред. Техника посева
4.1. Цель занятия
Ознакомиться с техникой приготовления основных питательных сред, применяемых в ветеринарных лабораториях. Ознакомиться с термостатами для культивирования микроорганизмов. Освоить методы посевов микроорганизмов на жидкие и плотные питательные среды (МПБ и «косой» МПА в пробирке), а также метод рассева на чашке Петри с МПА.
4.2. Материалы и оборудование
Компоненты для приготовления питательных сред: агар-агар, пептон, желатина, химически чистый NaCl, сухие питательные среды — полуфабрикаты, колбы с МПБ, МПА, пробирки с готовыми МПБ, МПА («косой агар), чашки Петри с МПА, бактериальные петли, шпатели, карандаши по стеклу, горелки, спички.
Пробирки с культурами микроорганизмов, смесь микробов в физиологическом растворе Bac. Subtilis, Васillus mesentericus, Bac. mycoides, мультимедийное устройство, презентация и таблицы по теме.
4.3. Теоретический материал
4.3.1. Требования к питательным средам
Основные требования, предъявляемые к питательным средам:
1) наличие необходимых питательных веществ (белки, углеводы, органические кислоты, многоатомные спирты, пептон, микро- и макроэлементы, витамины и др.);
2) оптимальная концентрация водородных ионов (рН), окислительно-восстановительного потенциала (Еh), активности воды (аw) осмотического давления;
3) стерильность — отсутствие живых микробов до посева;
4) прозрачность — для наблюдения за ростом микробов.
4.3.2. Классификация питательных сред и способы их приготовления
Питательные среды классифицируют по критериям исходных компонентов, химического состава, консистенции, целевого назначения. В зависимости от химического состава и исходных компонентов различают:
Среды неопределенного химического состава:
1) животного происхождения (исходные продукты — мясо, молоко, яйца, рыба и т.д.);
2) растительного происхождения (исходные продукты — картофель, морковь, горох, соя и т.д.).
Некоторые продукты используют в натуральном виде (картофель, молоко, морковь и т.д.), но чаще животные и растительные ткани подвергают обработке (ферментативному или кислотному гидролизу, экстрагированию).
Среды известного химического состава (синтетические). В них входят известные химические соединения (углеводы, аминокислоты, соли, витамины и т.д.) в оптимальном соотношении. Синтетические среды используют, когда выращиваемую клеточную массу необходимо максимально освободить от балластных органических соединений, входящих в состав обычных сред. По физическим свойствам питательные среды могут быть жидкими, полужидкими, плотными и сыпучими.
Жидкие питательные среды. Готовят, используя экстракты, гидролизаты, растворы из исходных продуктов.
Полужидкие и плотные питательные среды. Жидкие питательные среды уплотняют внесением желатины и агар-агара.
Агар-агар — продукт переработки морских водорослей, полисахарид. Плавится при 80–86 °С, затвердевает при 40 °С. Для получения плотных сред его добавляют в количестве 1,5–3%, полужидких — 0,3–0,7% (рис. 4.1).

Рис. 4.1. Агар-агар: а — водоросли Gracilaria и Gelidium — два основных источника для производства агар-агара; б — сухие пластинки агар-агара; в — агар-агар в порошке
Желатина — готовят экстракт из переработанных костей, хрящей, сухожилий, связок, содержащих в большом количестве коллаген. Желатиновый гель плавится при 25 °С, что делает его неудобным для выращивания микроорганизмов с температурным оптимумом 37–38 °С. Кроме того, ряд бактерий выделяют протеолитические ферменты, разлагающие желатину. В питательные среды вносят 10–20% желатины. На МПЖ делают посев уколом. Среда применяется для исследования на аэробиоз.
По целевому назначению различают общеупотребительные (основные), обогащенные, специальные, дифференциально-диагностические, элективные (избирательные) питательные среды.
Общеупотребительные (основные) среды. Это среды, в которых культивируют неприхотливые микробы.
В качестве компонентов для приготовления основных сред применяют мясную воду, перевар Хоттингера, растительные гидролизаты.
Мясная вода — говядину освобождают от костей, связок, сухожилий, жира и готовят фарш. Фарш заливают 2 л водопроводной воды и кипятят 1,5 ч. Мясную воду охлаждают, фильтруют и доливают воду до первоначального объема. Затем разливают по емкостям, закрывают ватно-марлевыми пробками и автоклавируют при 120 °С 20 мин.
Перевар (гидролизат) Хоттингера. Мясо (1 кг) нарезают кусочками по 1–2 см и опускают в кастрюлю с 2 л кипящей воды. Кипятят 20 мин, затем извлекают и готовят фарш. В оставшейся жидкости устанавливают рН 8,0, опускают в нее фарш, охлаждают до 40 °С и добавляют поджелудочную железу (в виде фарша, дважды пропущенную через мясорубку) из расчета 100 г на 1 л жидкости (или 0,5 г сухого панкреатина). Тщательно размешивают и через 30 мин снова подщелачивают (отсутствие сдвига реакции в кислую сторону указывает на недоброкачественность фермента). После установления рН смесь переливают в бутыль с плотной резиновой пробкой (1/3 бутылки оставляют свободной) и вносят 1–3% хлороформа (в холодное время года меньше), закрывают пробкой, хорошо встряхивают и на минуту вынимают пробку для освобождения от избытка паров хлороформа. Через 1–2 ч после добавления фермента опять проверяют реакцию и устанавливают рН 7,4–7,6. Смесь оставляют на 10–16 дней при комнатной температуре или 7–10 дней при 37 °С. Первые 3–4 дня переваривания ежедневно проверяют и исправляют реакцию, перевар встряхивают не менее 3 раз в сутки. В дальнейшем встряхивать можно реже. За 1–2 дня до окончания переваривания встряхивание прекращают, чтобы перевар отстоялся. Переваривание прекращают по следующим признакам: на дне бутылки собирается пылевидный осадок, надосадочная жидкость просветляется и принимает соломенно-желтый цвет, реакция на триптофан с бромной водой положительная (максимальное содержание триптофана 2,00–3,00 г/л), в гидролизате содержится 11,00–12,00 г/л азота (7,00–9,00 г/л аминного азота). После окончания гидролиза перевар фильтруют через полотняный или бумажный фильтр, разливают в бутылки, колбы и стерилизуют в автоклаве при 120 °С в течение 30 мин. Далее используют по назначению.
Мясопептонный бульон (МПБ). К 1 л мясной воды добавляют 10 г пептона и 5 г химически чистого хлорида натрия. Смесь кипятят при постоянном помешивании 15–20 мин, устанавливают рН 7,2–7.4, фильтруют через бумажный фильтр, разливают в колбы и пробирки. Стерилизуют при 120 °С в течение 20 мин. Содержание аминного азота в готовой среде — 1,2 г/л.
Мясопептонный агар (МПА). К 1 л мясопептонного бульона прибавляют 15–25 г (1,5–2,5%) мелко нарезанного агар-агара. Кипятят, перемешивая до полного растворения агар-агара. Устанавливают рН 7,4–7,6. Фильтруют, разливают в колбы или пробирки, стерилизуют при 120 °С в течение 20–30 мин. Чтобы получить скошенную поверхность агар-агара, удобную для посева, после стерилизации пробирки с расплавленным МПА оставляют при комнатной температуре до уплотнения в наклонном положении (конец с пробкой приподнят) (рис. 4.2).
Широко используют культивирование микроорганизмов на плотных питательных средах в чашках Петри. Диаметр стандартной чашки Петри — около 10 см; они бывают разных диаметров, выпускают также одноразовые пластиковые стандартные стерильные. Над пламенем горелки наливают около 20 мл расплавленного и охлажденного до 45–50 °С питательного агар-агара, чашки помещают на горизонтальную поверхность до застывания агар-агара.

Рис. 4.2. Приготовление скошенного агара
Полужидкий мясопептонный агар (ПЖА) готовят, как МПА, но добавляют 0,25% агар-агара. Кипятят при помешивании до полного расплавления агар-агара, устанавливают рН 7,2–7,6, фильтруют в горячем виде, стерилизуют в автоклаве.
Мясопептонная желатина (МПЖ). К 1 л МПБ добавляют 10–20 г желатины, нагревают до ее расплавления, устанавливают рН 7,2–7,4, кипятят, фильтруют через ватно-марлевый фильтр, разливают по пробиркам и стерилизуют дробно в аппарате Коха три дня по 20 мин или однократно в автоклаве при 112 °С 15 мин.
Бульон Хоттингера. Перевар Хоттингера разводят водопроводной водой в соотношении 1:5–1:8 (до содержания аминного азота 120 мг%), добавляют 1,5% хлорида натрия, 0,1 г гидрофосфата калия, устанавливают рН 7,4–7,6, кипятят 15–20 мин, фильтруют через ватно-марлевый или бумажный фильтр, разливают по емкостям и стерилизуют при 120 °С 20–30 мин.
Агар Хоттингера. К 1 л бульона Хоттингера вносят 15–25 г (1,5–2,5%) агара. Кипятят перемешивая до полного растворения агара. Устанавливают рН 7,4–7,6. Фильтруют, разливают в колбы или пробирки, стерилизуют при 120 °С в течение 20 мин.
Предприятия биологической промышленности выпускают среды полуфабрикаты — готовые питательные бульоны и агар в виде сухого порошка.
Обогащенные среды. Многие виды болезнетворных бактерий плохо растут на общеупотребительных питательных средах или предъявляют особые требования к питательным средам. В этой связи в основные среды добавляют кровь, сыворотку крови, углеводы и т.д. Такие питательные среды получили название обогащенных.
Кровяной МПА — питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45–50 °С) питательному агару асептически добавляют 5–10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
Сывороточный и кровяной бульоны готовят аналогичным образом. Если микробы обладают гемолитическими свойствами, среды обесцвечиваются.
Для получения дефибринированной крови у барана кровь берут асептично из яремной вены стерильной иглой в стерильный флакон (или колбочку) со стеклянными бусинками, встряхивают вращательными движениями 15–20 мин, чтобы предотвратить свертывание крови. Фибрин наслаивается на бусинки.
Специальные среды. Это среды, разработанные с учетом специфических потребностей микробов.
Мясопептонный печеночный бульон (МППБ) Китта — Тароцци (рис. 4.3). Мясо или печень крупного рогатого скота нарезают мелкими кусочками, заливают трехкратным объемом МПБ или бульона Хоттингера (рН 7,4–7,6) и 30 мин кипятят. Затем среду фильтруют, печень (мясо) промывают водопроводной водой, подсушивают фильтровальной бумагой. По 3–4 кусочка мяса (печени) помещают в пробирку, наливают 7–8 мл бульона, покрывают слоем вазелинового масла и стерилизуют при 120 °С 20 мин. Перед использованием среду регенерируют (кипятят с последующим охлаждением).
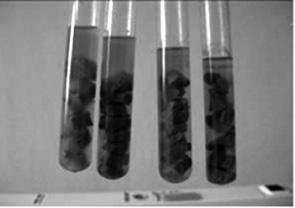
Рис. 4.3. Мясопептонный печеночный бульон (МППБ) Китта–Тароцци
Мозговая среда (МС). Свежий мозг (не позже чем через 18 ч после убоя животного) очищают от пленок и пропускают через мясорубку. Мозговой фарш заливают водопроводной водой (1 часть мозгового фарша на 1 часть воды) и протирают через сито. Реакция протертой массы должна быть нейтральной или слабощелочной. Стерилизуют текучим паром в течение 2 ч. Затем раскладывают по пробиркам высоким столбиком и стерилизуют в течение 2 ч при 110 °С. Для более быстрого почернения мозговой среды при культивировании анаэробов рекомендуется добавить 0,05% сернокислого железа.
Основной перфрингенс-агар (пропись фирмы «Дифко», 1982). Среду используют для изготовления TSC- или SFP-arapa при предварительной идентификации и подсчете Сl. perfringens. В 1000 мл дистиллированной воды растворяют 15 г триптозы, 5 г соевого пептона, 5 г мясного экстракта (сухого), 5 г дрожжевого экстракта, 1 г натрия метабисульфита, 1 г железа аммонийно-цитратного, 14 г агара. Устанавливают рН 7,6, стерилизуют при 121 °С 10 мин. Затем среду охлаждают до 50 °С и вносят соответствующие селективные добавки.
Бульон Вейнберга для анаэробов. 1 кг бычьего сердца пропускают через мясорубку, добавляют к фаршу 1 л воды, нагревают до кипения, охлаждают, снимают жир. Смешивают 400 г печени, 400 г свиных желудков, 40 г соляной кислоты, 4 л воды, подогретой до 50 °С, и выдерживают при этой температуре 18–24 ч. Затем подогревают до 100 °С, жидкость сливают, фильтруют, добавляют 0,2% двуосновного фосфорнокислого натрия и устанавливают рН 7,4. Затем смешивают 1 л мясной воды из сердца быка и 2 л полученного пептона, устанавливают рН 7,8–8,2 и стерилизуют при 120 °С 30 мин. Бульон разливают по пробиркам с кусочками вареной печени, наливают стерильное вазелиновое масло слоем 0,5 см и вновь стерилизуют при 120 °С 30 мин. Перед посевом к бульону добавляют стерильный раствор глюкозы до 0,5%.
Бульон и агар Мартена. Для приготовления среды Мартена используют продукты переваривания свиных желудков (или сычуга рогатого скота). Желудки очищают от жира, фасций, измельчают в мясорубке и заливают водой 1:4 с добавлением к общему объему жидкости 1%-ной соляной кислоты. Смесь выдерживают сутки при 50 °С, нейтрализуют 20%-ным раствором NaOH до щелочной реакции (посинение лакмусовой бумажки), автоклавируют при 120 °С 15 мин. Затем смешивают равные количества полученного перевара и мясной воды, кипятят 10 мин, подщелачивают 20%-ным NaOH до рН 7,9, кипятят 30 мин, фильтруют через бумажный фильтр, разливают по пробиркам, колбам и автоклавируют при 0,5 атм. 30 мин. Для приготовления плотной среды к полученному бульону Мартена добавляют 2–3% агара, определяют рН, фильтруют, как обычный МПА, стерилизуют при 0,5 атм. 30 мин.
Дифференциально-диагностические среды. Предназначены для дифференциации одних видов микробов от других по выявлению ферментов. В состав этих сред кроме питательной среды входит субстрат для обнаружения фермента и индикатора, по изменению цвета которого судят о сдвиге рН среды в результате расщепления субстрата. К дифференциально-диагностическим относятся среды Эндо, Гисса, Левина, Плоскирева и др.
Среда Эндо (рис. 4.4, б) — дифференциально-диагностическая среда для выделения и идентификации кишечных бактерий. В ее состав входят: 1% пептона, 1% лактозы, 35% К2НРO4, 1,5% агара. Все ингредиенты, за исключением лактозы, растворяют в воде при кипячении или в автоклаве. Во избежание карамелизации сахара лактозу добавляют после растворения всех остальных компонентов среды. Кроме лактозы, среда не должна содержать никаких других углеводов, поэтому при ее изготовлении нельзя применять мясную воду. Для этого используют любой пептон или гидролизат белков. Индикатор готовят ex tempore и добавляют к расплавленной питательной основе. Среда может быть использована сразу после приготовления без предварительной стерилизации. При необходимости ее стерилизуют в течение 30 мин при температуре 110 °С, рН среды — 7,4–7,6.
Индикатором служит соединение основного фуксина с сернистокислым натрием. Приготовление индикатора: 0,25 г безводного сернистокислого натрия или 0,5 г кристаллического (из расчета на 100 мл среды) растворяют в 5 мл дистиллированной воды и добавляют спиртовой (1–2%) раствор основного фуксина до тех пор, пока раствор из красного не превратится в бледно-розовый.
Приготовленный индикатор добавляют к расплавленной питательной основе и после тщательного перемешивания среду разливают в стерильные чашки Петри, которые подсушивают в термостате при 37 °С в течение 30 мин в открытом состоянии. Готовая к употреблению среда Эндо имеет бледно-розовый цвет либо бесцветна; она должна быть использована в течение суток, так как при длительном хранении происходит ее покраснение, и она становится непригодной.
Колонии бактерий, сбраживающих лактозу (кишечная палочка), на среде Эндо приобретают интенсивный красный цвет с металлическим оттенком. Бактерии, не сбраживающие лактозу (тифопаратифозные и дизентерийные) формируют колонии бесцветные либо цвета окружающей среды.
В среде Эндо основной фуксин, в химическом отношении являющийся производным солянокислого розанилина, при соединении с сернистокислым натрием вследствие редуцирования обесцвечивается. При росте бактерий, разлагающих лактозу, промежуточный продукт (ацетальдегид), возникающий в результате окисления сахара, реагирует с сернистокислым натрием, и фуксин вновь приобретает красный цвет.
Биофабрики выпускают и сухой агар Эндо. При изготовлении среды Эндо берут 5 г порошка на 100 мл дистиллированной воды, нагревают до его растворения и, прокипятив 5 мин, разливают в стерильные чашки Петри.
Необходимо помнить, что фуксин обладает бактериостатическим действием, которое более выражено при температуре 37 °С. Поэтому учет результатов следует производить через 24 ч после инкубации в термостате и 24–48 ч выдерживания посевов при комнатной температуре.
Среда Гисса («пестрый ряд», рис. 4.4, а) — используют для выявления сахаролитической активности энтеробактерий. В дистиллированной воде растворяют 1% пептона и 0,5% поваренной соли. Затем прибавляют 1% индикатора Андреде (кислый фуксин в растворе NaOH) или 0,1% спиртового раствора бромтимолового синего и нагревают до 80 °С. Затем при комнатной температуре доводят рН до 7,2. Смесь кипятят 5 мин, фильтруют и доливают водой до первоначального объема. Добавив 1% одного из углеводов (глюкоза, лактоза, мальтоза, манит, сахароза и др.), среду разливают по пробиркам с поплавками для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
При изготовлении полужидких сред Гисса следует добавлять 1% углеводов и 0,4% агара. Среды стерилизуют в течение 3 дней текучим паром по 30 мин или автоклавируют 15 мин при 0,5 атм. Среду Гисса выпускают полужидкой с индикатором BP (смесь водного голубого и розоловой кислоты).
Среда Левина (рис. 4.4, в) — цветная элективная среда для дифференцирования микроорганизмов кишечной группы, аналогична среде Эндо, но содержит индикатор эозин с метиленовой синью. Стабильна при хранении в течение нескольких дней. Наличие в среде лактозы позволяет выделять патогенную микрофлору, не способную разлагать этот углевод. Входящие в состав среды Левина органические красители задерживают рост сапрофитов, что позволяет использовать среду для непосредственного засева исследуемого материала.
Наиболее удобно впрок раздельно подготовить основную среду, растворы лактозы и красителей и смешивать их перед применением.
Основная среда: 1) 10 г пептона; 2) 15 г агара; 3) 2 г К2НРO4; 4) 1 л воды дистиллированной. Разливают по 100 мл и стерилизуют при 120 °С в течение 15–30 мин.
Дифференциальная среда: на каждые 100 мл расплавленной основной среды добавляют при помешивании следующие растворы, приготовленные на дистиллированной воде и простерилизованные дробно текучим паром три дня подряд. Ингредиенты: 1) 20%-ный раствор лактозы — 5 мл; 2) 2%-ный раствор эозина бактериологического — 2 мл; 3) 0,5%-ный раствор метиленового синего — 1,5 мл. Среду разливают в чашки Петри, подсушивают. Готовая среда имеет сине-фиолетовый цвет. При отсутствии пептона среду можно готовить на основе перевара Хоттингера (рН = 7,2–7,3). Широкое применение нашла сухая среда Левина, выпускаемая промышленностью.
Патогенные бактерии кишечной группы, не разлагая лактозы, растут на среде Левина в виде мелких, круглых, прозрачных, чаще бесцветных колоний, иногда с розоватым или голубоватым оттенком. Кишечная палочка образует на среде Левина небольшие гладкие колонии темно-синего цвета. У молодых колоний окраска может наблюдаться только в центре. Протей растет в виде небольших оранжево-желтых колоний, цвет среды вокруг колоний изменяется. Колонии других бактерий подобной картины не дают.
Агар Плоскирева — дифференциально-диагностическая и селективная среда, способствует лучшему росту некоторых бактерий (возбудителей брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка). Содержит питательный агар с лактозой, бриллиантовым зеленым, соли желчных кислот, минеральные соли (цитрат натрия, тиосульфат натрия, фосфат натрия, кальцинированная сода, хлорид натрия) и индикато — нейтральный красный. Навеску порошка растворяют в воде, кипятят и разливают в чашки Петри. Готовая среда прозрачная или розовая. Лактозонегативные колонии вырастают бесцветными, лактозопозитивные — красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
Молоко (обезжиренное) — естественная среда животного происхождения. Его слегка подщелачивают добавлением 1%-ной двууглекислой соды, проверяют реакцию лакмусовой бумажкой: легкое посинение ее свидетельствует о слабощелочной реакции молока. Фильтруют, разливают в стерильные пробирки, стерилизуют текучим паром дробно.
Элективные среды. Название происходит от латинского electus — избранный. Это питательные среды для избирательного выделения из материала и накопления микроорганизмов определенного вида. В эти среды вносят компоненты, обеспечивающие рост определенного микроорганизма, но подавляющие рост другой микрофлоры.
Молочно-солевой агар применяется для культивирования стафилококков. К 100 мл расплавленного МПА (рН 7,2–7,4), содержащего 6,0% хлорида натрия, добавляют 10 мл стерильного обезжиренного молока, перемешивают и стерильно разливают в чашки Петри.
Среда Мюллера (рис. 4.4, г) используется для накопления и культивирования сальмонелл. В колбу с 90 мл МПБ вносят 4,5 г мела, перемешивают, автоклавируют при 120 °С 30 мин. Затем вносят 2 мл раствора Люголя и 10 мл раствора тиосульфата натрия (тиосульфат натрия — 50 г, дистиллированная вода — 100 мл), стерилизуют в аппарате Коха 30 мин.
Среда Олькеницкого для культивирования сальмонелл. Состав: агар питательный сухой — 25 г, лактоза — 10 г, железоаммонийные квасцы (соль Мора) — 0,2 г, тиосульфат натрия — 0,3 г, мочевина — 10 г, 0,4%-ный водный раствор фенолового красного — 4 мл, дистиллированная вода — 1000 мл. Соли предварительно растворяют в небольшом объеме дистиллированной воды. Углеводы и мочевину также растворяют в небольших объемах воды при подогревании на водяной бане. Сухой питательный агар расплавляют в оставшемся объеме воды при нагревании и помешивании. Затем все компоненты соединяют, перемешивают с расплавленным агаром, фильтруют через марлевый фильтр, устанавливают рН 7,2–7,4, добавляют индикатор и разливают в пробирки по 6,0–7,0 мл. Среду стерилизуют текучим паром три дня по 20 мин и скашивают, оставляя столбик среды высотой 2,0–2,5 см. Готовая среда бледно-розового цвета.
Среда Ресселя для выделения сальмонелл: к 100 мл 1,5%-го мясо-пептонного агара (рН 7,2) прибавляют 1% лактозы, 0,1 % глюкозы и 1 мл индикатора Андреде, среду разливают в пробирки по 5,0–6,0 мл, стерилизуют в автоклаве при 112 °С 20 мин и скашивают, оставляя столбик среды высотой 2,0–3,0 см. Готовая среда бледно-розового цвета.
В состав сухой среды Ресселя входит сухой питательный агар, индикатор ВР, лактоза и глюкоза. Приготовленную среду разливают в стерильные пробирки и стерилизуют текучим паром два раза по 30 мин. Среду скашивают, оставляя столбик 2,0–2,5 см. Готовая среда фиолетового или розовато-серого цвета. Посевы инкубируют в термостате при 37 °С 18–20 ч.
Среда Кауфмана — это среда обогащения для сальмонелл. К 100 мл среды Мюллера добавляют 1 мл 0,1%-ного водного раствора бриллиантового зеленого, разведенного 1:1000 и 5 мл стерильной бычьей желчи. Смесь стерилизуют текучим паром 30 мин.
Среда Шустовой — для выделения сальмонелл. К 100 мл расплавленного и охлажденного до 50 °С МПА (рН 7,4) добавляют 10 мл среды 50%-го водного раствора тиосульфата натрия и 2 мл раствора Люголя.
Среда Раппопорт — среда для культивирования сальмонелл. К 100 мл расплавленного до 50 °С МПА добавляют 1 г глюкозы, 10 мл желчи, 1 г индикатора Андраде. Стерилизуют текучим паром.
Казеиново-угольный агар (КУА) с пенициллином (рис. 4.4, д) используют для культивирования бордетелл. К 1000 мл дистиллированной воды добавляют 25 мл панкреатического гидролизата казеина, 5 г хлорида натрия, 0,2 г хлорида калия, 0,002 г хлорида кальция, 0,4 г карбоната натрия, 0,015 г хлорида магния, 0,015 г калия фосфорнокислого однозамещенного, 1,5 г растворимого крахмала, 0,03 г цистина, 15 г агара. Компоненты растворяют, устанавливают рН 7,2, стерилизуют при 0,5 атм. 30 мин. Перед использованием в расплавленный до 45 °С агар вносят 3% дрожжевого экстракта, 0,2% сухого акти
...