автордың кітабын онлайн тегін оқу Фармацевтическое право
А.В. Препьялов
В.Н. Шестаков
ФАРМАЦЕВТИЧЕСКОЕ ПРАВО
Учебник
Издательский дом «Городец» благодарит за оказанную помощь
в выходе издания независимую частную российскую производственную
компанию «Праймлайн» (www.prime-l.ru)
ПРАЙМЛАЙН: КОМПЛЕКСНЫЕ ЕРС-ПРОЕКТЫ
© Препьялов А.В., Шестаков В.Н., 2023
© Издательский дом «Городец» —
оригинал-макет (верстка,
корректура, редактура, дизайн),
полиграфическое исполнение, 2023
Все права защищены. Никакая часть электронной версии этой книги не может быть воспроизведена в какой бы то ни было форме и какими бы то ни было средствами, включая размещение в сети Интернет и в корпоративных сетях, для частного и публичного использования без письменного разрешения владельца авторских прав.
@ Электронная версия книги подготовлена
ИД «Городец» (https://gorodets.ru/)
Хороший корень питает молодые побеги, помогая им превратиться в дерево. Так и работа авторов над настоящим изданием является результатом протяженного и ежедневного внимания со стороны профессора Н.А. Заикиной, замечательного стойкого человека.
Благодарные авторы посвящают ей этот труд
Введение
В начале XX в. происходит принципиальное изменение подхода к изготовлению лекарственных средств: если раньше врач создавал лекарство, указывая фармацевту, как его изготовить, то с развитием промышленности образуется и новое направление — фармацевтика. Теперь уже производители говорят врачу, как надо применять выпускаемое ими лекарство. Лекарственные средства начинают производиться не для лечения одного пациента (как делалось раньше в аптеке), а для лечения заболевания целых групп людей, страдающих от этого заболевания. Возникновению фармацевтической промышленности способствует развитие различного рода наук: фармации, фармакологии, фармакогнозии и синтетической химии. Именно развитие последней легло в основу появления фармацевтической промышленности.
Соответственно, увеличивается число субъектов, вступающих в правоотношения, связанные с лекарственными средствами. Вместо привычного круга (врач — аптекарь — пациент) появляются другие участники (фармацевтические компании, медицинские организации), которые являются уже юридическими лицами. Нельзя сказать, чтобы врач и аптекарь осуществляли некоммерческую деятельность, но появление промышленного производства лекарств, безусловно, было более ориентировано на извлечение прибыли. Одновременно с этим предприятиям нужны были новые разработки лекарств, которые предоставляли им научные организации.
В сложившихся условиях государство вынуждено было начать правовое регулирование обращения лекарственных средств. С одной стороны, законодательное регулирование было направлено на защиту публичных прав — здоровье граждан, с другой стороны, на защиту частных прав участников (например, Парижская конвенция по охране промышленной собственности 1883 г.). Первый специальный закон в мире по лекарственным средствам Food and Drug Act был принят 30 июня 1906 г. В России первый специальный закон «О лекарственных средствах» появился много позже — в 1998 г. Данное обстоятельство было обусловлено тем фактом, что фармацевтика СССР не преследовала извлечения прибыли в качестве основной цели. Только возникновение частных собственности и производства лекарственных средств на ее основе обусловили формирование законодательства.
Во многих странах правовые вопросы обращения лекарственных средств в совокупности обозначаются, как «Фармацевтическое право» (Pharmaceutical Law, Pharmarecht). С позиции теории права, безусловно, нельзя говорить о фармацевтическом праве, как о самостоятельной отрасли права. Скорее, данный вид права представляет комплексный институт права, элементы которого, имеющие свою специфику, можно найти в различных отраслях права (государственного, административного, гражданского, коммерческого и т.д.). Тем не менее для простоты обозначения вопросов права, регламентирующих отношения, объектом которых является лекарственное средство, такой термин вполне приемлем. Важно и другое: в настоящее время нормы права во многом не столько фиксируют, узаконивают, сложившиеся отношения, сколько создают основу для формирования новых отношений между субъектами, достижения результатов которых преследуется государством (например, развитие фармацевтического производства на территории страны). В связи с этим часто рассматриваемую совокупность правоотношений именуют «правовым регулированием обращения лекарственных средств» (англ. Regulatory Affairs).
За последние 30 лет сформирован большой объем законодательства Российской Федерации в сфере обращения лекарственных средств, который требует не только его знания и применения в практической деятельности, но и способности корректно трактовать положения различных нормативных актов, технических документов и понятий фармацевтических наук. Далее будут рассмотрены основные направления, образующие фармацевтическое право, позволяющие создать «костяк» представлений, который позволит понимать и правильно применять на практике положения многочисленных нормативно-правовых актов Российской Федерации.
Тема 1
Лекарственное средство
как объект правоотношений1
Понятие «Обращение лекарственных средств». Субъекты обращения лекарственных средств. Система законодательства Российской Федерации, регулирующая обращение лекарственных средств. Этапы обращения лекарственного средства.
| К объектам гражданских прав относятся вещи, включая наличные деньги и документарные ценные бумаги, иное имущество, в том числе безналичные денежные средства, бездокументарные ценные бумаги, имущественные права; результаты работ и оказание услуг; охраняемые результаты интеллектуальной деятельности и приравненные к ним средства индивидуализации (интеллектуальная собственность); нематериальные блага. Ст. 128 ГК РФ «Объекты гражданских прав» |

|
| С позиции уголовного права лекарственное средство является предметом преступления (объектом же преступления признаются важнейшие социальные ценности, интересы, блага, охраняемые уголовным правом от преступных посягательств) |
Положения гражданского права относят лекарственные средства к категории вещей, которые, как правило (если речь идет о рецептурных лекарственных средствах), ограниченно находятся в обороте. Тем не менее вряд ли найдется человек, который за свою жизнь не получал и не принимал лекарственного средства. Исходя из теории права лекарственное средство является объектом правоотношений. Законодательное определение «лекарственного средства» дано в ст. 4 Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств». Согласно ему лекарственные средства — это вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты, к которым относятся дозированные лекарственные средства в лекарственных формах (таблетки, капсулы, настойки, растворы и т.д.).
Одновременно с этим лекарственное средство в свете ст. 1 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза 2014 г. является средством, содержащим вещество или комбинацию веществ, вступающее в контакт с организмом человека, предназначенное для лечения, профилактики заболеваний человека или восстановления, коррекции или изменения его физиологических функций посредством фармакологического, иммунологического либо метаболического воздействия или для диагностики заболеваний и состояний человека.
Вполне логичным представляется, что применение лекарственных средств направлено на восстановление или защиту здоровья человека, под которым, в свою очередь, в российском законодательстве понимается состояние физического, психического и социального благополучия человека, при котором отсутствуют заболевания, а также расстройства функций органов и систем организма (ст. 2 Федерального закона от 21 ноября 2011 г. № 323-ФЗ (ред. от 29 декабря 2015 г.) «Об основах охраны здоровья граждан в Российской Федерации»), что не полностью соответствует Преамбуле к Уставу Всемирной организации здравоохранения, принятому Международной конференцией здравоохранения, Нью-Йорк, 19–22 июня 1946 г. (согласно Преамбуле здоровье является состоянием полного физического, душевного и социального благополучия, а не только отсутствием болезней и физических дефектов).
Вычленение лекарств из объектов материального мира считается важным по той причине, что к иным близким к лекарственным средствам, объектам (биологически активным добавкам, изделиям медицинского назначения, химическим веществам) применяются более простые административные режимы.
Статья 128 ГК РФ устанавливает, что к объектам гражданских прав относятся вещи, иное имущество и нематериальные блага. «Лекарственное средство» следует отнести к одному из институтов гражданского права — вещному праву. Традиционно, наследуя положения римского права, под вещью понимается материальный объект, в отношении которого возникает право владения.
В качестве первого признака лекарственного средства, позволяющего отнести его к вещи, является материальность. Исходя из подхода определения вещи по источнику возникновения, лекарственное средство может быть как природного, так и искусственного (созданного человеком) происхождения. В качестве примера природного источника возникновения можно привести не только объекты растительного мира, которые стали применяться в качестве лекарственных средств задолго до появления искусственных объектов, созданных человеком, но и некоторые химические соединения, встречающиеся в природе в изолированном состоянии (например, йод, натрия хлорид). Лекарственные средства природного происхождения образуются в материальном мире вне волеизъявления человека и не связаны до определенной степени с трудом.
Вторым признаком лекарственного средства является его отнесение к числу движимого имущества. Согласно п. 2 ст.130 ГК РФ вещи, не относящиеся к недвижимости, включая деньги и ценные бумаги, признаются движимым имуществом. Регистрации прав на движимые вещи не требуется, кроме случаев, указанных в законе. Хотя в отношении лекарственного средства (точнее лекарственного препарата) нормой ст. 13 Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств», на территории Российской Федерации установлен правовой институт государственной регистрации (в зарубежных странах существует аналогичный правовой институт публичного права — Marketing authorisation), осуществляемой соответствующим уполномоченным федеральным органом исполнительной власти, с которым связана оборотоспособность лекарственного препарата, однако государственная регистрация лекарственного препарата, в отличие, например, от государственной регистрации прав на недвижимое имущество, не означает признание (подтверждение) государством факта возникновения, изменения или прекращения прав на имущество.
Третьим признаком лекарственного средства, позволяющим последнему выступать в качестве объекта гражданских прав, считается определенная материальная ценность. Лекарственное средство является овеществленным результатом труда. Экономическая стоимость лекарственного средства определяется не только стоимостью сырья, но и вложенным трудом человека. Даже дикорастущие растения перед тем, как они станут лекарственными средствами и приобретут материальную ценность, необходимо собрать, высушить, измельчить, приготовить к применению в лечебных целях. Не случайно законодательно закреплено правовое регулирование сбора лекарственных растений (ст. 34 Лесного кодекса РФ).
К четвертому признаку, являющемуся родовым, относится то, что лекарственные средства воздействуют на организм человека (или животного, если речь идет о ветеринарии), вызывая в последнем определенный положительный (ожидаемый) биологический ответ. В связи с этим следует обратить внимание, что лекарственное средство, во-первых, должно вступить в физический контакт с организмом живого существа. Существует множественность путей введения фармакологически активного вещества в организм. Дистанционное воздействие без контракта материального объекта с организмом не может быть признаком лекарственного средства. В данном случае сложность представляют летучие вещества, многие из которых имеют двойное назначение (например, ароматерапия и соседняя парфюмерия). Обязательным условием родового признака должен быть «положительный» биологический ответ, позволяющий отделить лекарственное средство от прежде всего химических веществ, большинство из которых также оказывают фармакологическое воздействие на организм, чаще всего неблагоприятное (показательным такого вида воздействия являются яды). По этой причине возникает сложность установления данного родового признака, поскольку подавляющее большинство лекарственных средств обладают такой характеристикой, как токсичность. Хорошо известна цитата Парацельса — «всё есть яд и всё есть лекарство. Только доза делает лекарство ядом и яд лекарством».
Изначально родоначальником правового регулирования обращения лекарственных средств являются США, принявшие в 30 июня 1906 г. первый в мире закон о продуктах и лекарствах (Food and Drug Act), положения которого направлены исключительно на регулирование вопросов маркировки продукции. Не раскрывая понятие «лекарственное средство», акт указывал, что лекарственные средства, качество которых устанавливалось Фармакопеей Соединенных Штатов, не могут продаваться иначе как при указании на этикетке конкретных отклонений от применимых стандартов. 1938 г. в США принимается специальный закон — Закон о пищевых продуктах, лекарствах и косметических средствах (Food, Drug and Cosmetic Act). В соответствии с п. (g) 1 Sec 201 главы II Food, Drug and Cosmetic Act 2002, под термином «лекарственное средство» понимаются:
(А) предметы, признанные путем публикации в официальной Фармакопее США, в официальной гомеопатической фармакопее Соединенных Штатов или в официальном Национальном формуляре, или в качестве дополнения к любому из них;
(B) предметы, предназначенные для использования в диагностике, уходе за больным, для облегчения течения заболевания, лечения или профилактики заболеваний человека или животных;
(C) предметы (кроме пищевых продуктов), оказывающие влияние на структуру или любую функцию тела человека или животного;
(D) предметы, предназначенные для использования в качестве компонента любого из предметов, указанных в пунктах (А), (В) или (С).
Таким образом, законодательство США, помимо всего, в качестве одного из альтернативных признаков выделяет юридический факт — опубликование в соответствующем сборнике технических норм — государственной фармакопее2. Кроме того, определение позволяет произвести градацию лекарственных средств на конечные, готовые к применению (в российском праве — «лекарственные препараты»), и исходные лекарственные средства — сырье для производства готовых к применению (в российском праве наиболее близкий, но неполный термин «фармацевтические субстанции»).
Впервые на территории Российской Федерации термин «лекарственное средство» был закреплен в Федеральном законе от 22 июня 1998 г. № 86-ФЗ «О лекарственных средствах» (утратил силу 31 августа 2010 г.), структура и нормы которого были достаточно близки к Arzneimittelgesetz (Закон о лекарственных средствах) Германии, которая так же, как и Российская Федерация, относится к романо-германской правовой семье. Согласно определению данному в подп. 1 п. 2 Arzneimittelgesetz (принят в 1961 г., новая редакция — 1976, с изменения на 2019), к лекарственному средству относится вещество и объект, полученный из веществ, которые должны быть определяемы, и применяются поверхностно или вводятся внутрь организма:
1. Для лечения, облегчения течения заболевания, предупреждения или диагностики заболеваний, недомоганий, травм или жалоб на боль;
2. Позволяют узнать свойства, состояние или функции организма, а также психические состояния;
3. Замещают в человеческом организме или организме животного вырабатываемые активные вещества или физиологические жидкости;
4. Уничтожают или делают безвредными возбудителя болезни, паразитов или обезвреживают инородные вещества;
5. Влияют на свойство, состояние или функции организма, или психические состояния.
При этом согласно подп. 1 п. 2 к лекарственным средствам относятся вещества, которые содержат лекарственное средство согласно п. 1 или при помощи которых лекарственное средство доставляется согласно п. 1 и которые к тому определены, постоянно или временно соприкасаются с организмом человека или животного.
Осуществляя последовательную политику гармонизации законодательства стран-членов Европейского Союза, 26 января 1965 г. принимается первая фармацевтическая Директива 65/65/EEC1, направленная на сближение положений, предусмотренных регулирующим законом или административным актом, в отношении зарегистрированных лекарственных средств.
Согласно ст. 2 Директивы, под лекарственным средством понимается любое вещество или комбинация веществ, предназначенных для лечения или профилактики заболеваний у людей или животных. При этом любое вещество или комбинация веществ, которые могут вводиться людям или животным с целью постановки медицинского диагноза или восстановления, коррекции или модификации физиологических функций у человека или у животных, также считается лекарственным средством.
Положениями Директивы постулируется, что веществом признается любой объект независимо от происхождения, которым может быть:
- человек, например, кровь человека и продукты крови человека;
- животное, например, микроорганизмы, целые животные, части органов, выделения животных, токсины, экстракты, продукты крови и т.д.;
- объекты растительного мира, например, микроорганизмы, растения, части растений, растительные выделения, экстракты и т.д.;
- химическое соединение, например, химические элементы, природные химические соединения и химические продукты, полученные путем химической модификации или синтеза.
Возвращаясь к законодательству Российской Федерации, отмечаем, что к определению «лекарственное средство» немецкого закона, достаточно близко примыкает определение Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» (п. 1 ст. 4), согласно которому «лекарственные средства — вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий».
Важным является тот факт, что с позиции правового статуса понятия «вещь», «вещество», «предмет», «объект», которыми описывается термин «лекарственное средство» законодательствами вышеуказанных стран, являются идентичными и представляют собой объект материального мира, имеющего товарную ценность. Законодательство всех рассмотренных стран устанавливает, что обязательным признаком лекарственного средства является его контракт с организмом человека (поверхностный или внутренний) или животного и биологически активное воздействие (замещение) на функции или части организма.
Следует отметить, что так же, как и в рассмотренных странах, законодательно в Российской Федерации к лекарственным средствам относятся фармацевтические субстанции (предназначены для производства, изготовления лекарственных препаратов и определяют их эффективность. Не предназначены для конечного потребителя) и лекарственные препараты (лекарственные средства в виде лекарственных форм. Предназначены для конечного потребителя). Для удобства практического применения лекарственных препаратов, последние выпускаются в лекарственных формах. Законодательство зарубежных стран использует различные определения, правовое наполнение которых не меняется. Так, фармацевтические субстанции, чаще всего, именуются substances или active pharmaceutical ingredients, а лекарственные препараты — medicines, drugs или pharmaceutical products (под данным термином в праве США понимают лекарственные препараты, отпускаемые по рецепту организациями, имеющими на это право). В свою очередь, лекарственные препараты по источникам происхождения делятся на промышленные и аптечные.
Вообще, принятие во внимание лекарственной формы3 при рассмотрении вопроса относится ли объект к лекарственным средствам или нет, носит факультативный, дополнительный признак, который должен рассматриваться вместе с другими признаками лекарственного средства. Так, например, таблетированная форма натрия хлорида используется в системах умягчения воды (в данном случае химическое вещество не взаимодействует с организмом и соответственно не оказывает на последний фармакологического воздействия), а форма крема или мази широко применяется для парфюмерно-косметической продукции. В то же время лекарственная форма в комплексе с другими признаками может способствовать обоснованному отнесению объекта гражданского оборота к лекарственным средствам. Лекарственная форма в качестве дополнительного признака играет значительную роль при таможенном оформлении товаров и определении налоговой ставки (НДС на лекарственные средства составляет 10%, в отличие от обычных 20%). Существенные трудности при отнесении объекта к лекарственным средствам испытывают таможенные органы, поскольку товарная номенклатура внешнеэкономической деятельности4 позволяет один и тот же объект отнести к различным группам товарных позиций.
Возвращаясь к законодательному разграничению лекарственных средств на лекарственные препараты и фармацевтические субстанции, хотелось бы остановиться на следующем. Во-первых, фармацевтические субстанции, в отличие от фармацевтических препаратов, не подлежат государственной регистрации (ст. 13 Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств»). Во-вторых, фармацевтические субстанции не предназначены для применения конечными потребителями — физическими лицами или животными. Субстанции являются сырьем для производства лекарственных препаратов, а их конечными потребителями являются только юридические лица (законодательство Российской Федерации не предполагает участие индивидуальных предпринимателей в качестве лицензиатов, осуществляющих производство лекарственных средств). В связи с этим дисбаланс вносит термин «лекарственное растительное сырье» (п. 13 ст. 4 Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств»), который, помимо источника сырья (свежие или высушенные растения либо их части), расширяет перечень участников гражданских отношений (организации — производители лекарственных средств, аптечные организации, ветеринарные аптечные организации, индивидуальные предприниматели, имеющими лицензию на фармацевтическую деятельность).
Хотелось бы остановиться на одном способе вычленения лекарственных средств из вещей, находящихся в гражданском обороте. Статья 135 ГК РФ устанавливает, что вещь, предназначенная для обслуживания другой главной вещи и связанная с ней общим назначением (принадлежность), следует судьбе главной вещи. Применимо к лекарственным средствам, фармацевтическая субстанция выступает в качестве принадлежности для производства главной вещи — лекарственного препарата. Производство лекарственных средств отнесено законодателем к лицензируемым видам деятельности (п. 16 ст. 12 Федерального закона от 4 мая 2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности»). Из двух вышеприведенных постулатов следует, что продукция, произведенная лицензиатом из фармацевтической субстанции (принадлежность), должна относиться к лекарственным средствам (главная вещь). При этом произведенное лицензиатам лекарственное средство может представлять собой не только лекарственный препарат, но и другую, вновь полученную, фармацевтическую субстанцию (например, смесь нескольких субстанций), а также промежуточный продукт (например, гранулят или лекарственную форму in bulk).
С правовой точки зрения важным является установление момента возникновения лекарственного средства, поскольку именно с этим юридическим фактом связаны ограничительные меры в отношении объекта, находящегося в гражданском обороте. Как уже указывалось, лекарственное средство обладает материальной ценностью, часть которой создается в результате труда человека. Таким образом, дикорастущие лекарственные растения на участке, даже собственник которого определен, нельзя признать лекарственными средствами (что, кстати, противоречит правовому смыслу определения «лекарственное растительное сырье»), а вот искусственные посевы растений, поскольку они представляют овеществленный труд, уже можно отнести к лекарственным средствам. Следует признать, что установление момента возникновения фармацевтической субстанции — значительно более сложная задача, чем установление момента возникновения лекарственного препарата. Зачастую собственник материального объекта не знает, для каких целей будет использоваться производимая им продукция. Естественно, что последняя с позиции норм гражданского права не является главной вещью, а представляет собой принадлежность. Так, соцветия растений могут применяться как в фармацевтических, так и в парфюмерно-косметических целях; глюкоза имеет применение в пищевой промышленности намного более широкое, чем при производстве лекарственных препаратов. Тем не менее требования покупателя к качеству продукции (спецификация) с указанием методов анализа, установленных государственной фармакопеей, свидетельствуют, что действия участников гражданских правоотношений направлены именно в отношении лекарственного средства. В связи с этим моментом возникновения фармацевтической субстанции следует признать момент не столько само производство продукции, финальными стадиями которого являются упаковка и маркировка, сколько момент завершения контроля качества на соответствие параметрам, установленным для фармацевтической субстанции, по методам анализа, установленных государственной фармакопеей.
Необходимо также вычленить лекарственные средства от ближайших к ним вещей, находящихся в гражданском обороте: биологически активные добавки (БАД), медицинские изделия, химические соединения и парфюмерно-косметическая продукция.
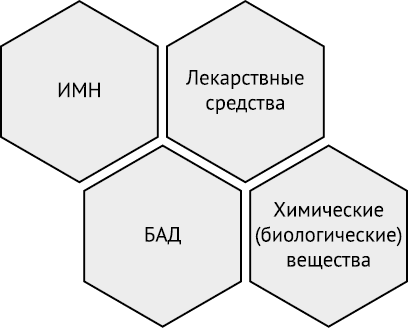
Технический регламент Таможенного союза «О безопасности пищевой продукции» (ТР ТС 021/2011), утвержденный Решением Комиссии Таможенного союза от 9 декабря 2011 г. № 880, устанавливает, что биологически активными добавками являются природные и (или) идентичные природным биологически активные вещества, а также пробиотические микроорганизмы, предназначенные для употребления одновременно с пищей или введения в состав пищевой продукции (ст. 4).
Более расширенное понятие БАД дается в п. 2.1 Санитарно-эпидемиологических правил и нормативов СанПиН 2.3.2.1290-03, введенных в действие постановлением Главного государственного санитарного врача РФ от 17 апреля 2003 г. № 50. Согласно этому определению БАД используются как дополнительный источник пищевых и биологически активных веществ, для оптимизации углеводного, жирового, белкового, витаминного и других видов обмена веществ при различных функциональных состояниях, для нормализации и/или улучшения функционального состояния органов и систем организма человека, в том числе продуктов, оказывающих общеукрепляющее, мягкое мочегонное, тонизирующее, успокаивающее и иные виды действия при различных функциональных состояниях, для снижения риска заболеваний, а также для нормализации микрофлоры желудочно-кишечного тракта, в качестве энтеросорбентов.
БАД так же, как и лекарственные средства, являются материальными объектами, относятся к движимому имуществу, имеют материальную стоимость, вступают в контакт с организмом человека, но, в отличие от первых, БАД не предназначены для лечения каких-либо заболеваний. Отсутствие положительного, лечебного эффекта БАД явилось основанием многочисленных решений ФАС России в отношении хозяйствующих субъектов о нарушении закона «О рекламе».
В отличие от лекарственных препаратов видовым признаком БАД является и путь введения в организм — только через рот с пищей (лекарственные средства характеризуются несколькими путями введения в организм: от внутривенного до трансдермального, т.е. через кожу). Кроме того, законодательно закреплен состав БАД — «природные и (или) идентичные природным биологически активные вещества, а также пробиотические микроорганизмы», т.е. вещества и микроорганизмы, которые «знакомы» организму. Еще одной отличительной особенностью БАД является трудность со стандартизацией качества БАД на основании методов, изложенных в государственной фармакопее.
В качестве основы для разграничения лекарственных средств и медицинских изделий, определение которых дано в ст. 38 Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», целесообразно использовать положения ст. 135 ГК РФ. Для корректного отнесения вещи к той или иной группе объектов гражданского оборота важно установить, что является главной вещью, а что — принадлежностью. Шприц, наполненный гиалуроновой кислотой, следует отнести к лекарственным средствам, поскольку воздействие на организм осуществляется все-таки гиалуроновой кислотой, а не средством доставки действующего вещества в организм. В то же время как стент, покрытый гепарином, применяемый у больных ишемической болезнью, является медицинским изделием, поскольку самостоятельное применение одного гепарина не влечет за собой того лечебного эффекта, какое оказывает операция стентирования.
Следующей отличительной особенностью медицинских изделий от лекарственных средств является то, что функциональное назначение медицинских изделий не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека, что прямо следует из буквального толкования нормы ч. 1 ст. 38 Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
Химические соединения являются наиболее сложными объектами (особенно, если речь идет не о лекарственных препаратах, а о фармацевтических субстанциях) с точки зрения их обособления от лекарственных средств. И те и другие обладают ценностной стоимостью, вступают в контракт с организмом человека и оказывают фармакологическое воздействие на последний. Правда, воздействие химического вещества не всегда является как положительным, так и ожидаемым. Тем не менее разделение рассматриваемых объектов возможно на основании трех неосновных признаков. Первый — формула химического соединения. Существует ряд синтезированных или полученных биохимическим способом соединений, для которых не свойственно иное отличное от фармацевтического, применение. Например, доксорубицина гидрохлорид используется в гражданском обороте только в лечебных целях. Вторым признаком, позволяющим отделить лекарственное средство от химического соединения, является лекарственная форма. Этот признак не является абсолютным, поскольку, лекарственные средства так же, как и химические соединения, встречаются в форме порошков и растворов, а иногда и химическим веществам придается удобная форма (например, таблетированная щелочь). Третьим и самым существенным из неосновных признаков является фармакологическое действие, определяемое дозировкой. Порой именно дозировка позволяет сделать заключение об отнесении применяемого вещества к лекарственным средствам: меньшая дозировка, по сравнению с зарегистрированной, не позволит достигнуть положительного лечебного эффекта, а большая — может быть опасной для жизни и здоровья (передозировка).
И, наконец, примыкающая к лекарственным средствам, парфюмерно-косметическая продукция (ПКП). Так же, как и лекарственное средство, ПКП может (но не всегда) обладать определенной фармакологической активностью. Однако данная активность, во-первых, мала, а, во-вторых, не носит направленного действия (не преследует достижения лечебно-профилактического эффекта). Вместе с тем в ряде случаев для разграничения требуются специальные познания и экспертная оценка (например, ароматерапия, несмотря на использование ПКП, преследует лечебные цели).
С точки зрения гражданского права лекарственное средство возникает до момента ввода его в гражданский оборот. Данный период связан с этапами разработки и государственной регистрации лекарственного средства. В свою очередь, разработка состоит из последовательных подэтапов: выделение (изоляция) лекарственного средства, доклинические исследования (in vitro — без участия живого организма, in vivo — с изучением свойств лекарственного средства на животных. Исследования у людей не осуществляются) и клинические исследования (исследования у людей).
В отличие от большинства вещей, правовое регулирование правоотношений в отношении которых не осуществляется с момента исчезновения вещи, в отношении лекарственного средства факт исчезновения последнего не является основанием для прекращения правоотношений. Такого рода правоотношения направлены на выявление последствий применения лекарственного средства: как с точки зрения его положительных свойств (например, лечебного эффекта), так и с точки зрения его отрицательных свойств (например, возможные побочные реакции организма на прием препарата).
Учитывая данные обстоятельства Федеральным законом от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» введено понятие «обращение лекарственных средств», под которым понимается разработка, доклинические исследования, клинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, отпуск, реализация, передача, применение, уничтожение лекарственных средств (п. 28 ст. 4). Понятие «обращение лекарственных средств» шире, чем «гражданский оборот лекарственных средств». Поскольку законодательство Российской Федерации не содержит четкого определения «гражданского оборота», на практике это вызывает определенные сложности, когда круг попадающих под данное определение правоотношений шире, чем отчуждение товара (так, например, немецкий Arzneimittelgesetz устанавливает, что ввод в гражданский оборот — это наличие складских запасов, предназначенных к продаже или иной форме отчуждения; предложение к продаже; продажа или иная форма отчуждения третьим лицам). В это же время Судебная коллегия по экономическим спорам Верховного Суда РФ в своем определении от 9 декабря 2015 г. по делу № 304-КГ15-8874, А67-4453/2014 указывает, что согласно подп. 1 п. 2 ст. 1484 ГК РФ исключительное право на товарный знак может быть осуществлено для индивидуализации товаров, работ или услуг, в отношении которых товарный знак зарегистрирован, в частности путем размещения товарного знака на товарах, в том числе на этикетках, упаковках товаров, которые производятся, предлагаются к продаже, продаются, демонстрируются на выставках и ярмарках или иным образом вводятся в гражданский оборот на территории Российской Федерации, либо хранятся или перевозятся с этой целью, либо ввозятся на территорию Российской Федерации. Из смысла данной нормы следует, что под иным введением в гражданский оборот понимается не только продажа или обмен, но и производство, предложение к продаже, демонстрация на выставках и ярмарках. При этом перечень способов введения в гражданский оборот товаров с использованием результатов интеллектуальной деятельности не является исчерпывающим.

Применительно к лекарственным средствам обращение последних включает гражданский оборот, разработку (в том числе государственную регистрацию лекарственного препарата) и фармаконадзор. При этом на всех этапах обращения лекарственного средства присутствуют как гражданские (предполагают равенство сторон и диспозитивный характер), так и административные правоотношения (наличие отношения «управляющий субъект — управляемый субъект» и императивный, установленный нормативными правовыми актами, характер).
Этапы обращения лекарственного средства включают: получение фармакологически активного компонента (не всегда этот компонент можно выделить и охарактеризовать — например, для биотехнологических продуктов), доклинические и клинические исследования, государственную регистрацию, производство, контроль качества, дистрибьюцию (оптовую и розничную) и применение. С развитием научных знаний и правового регулирования фармацевтического сектора увеличивается время и стоимость создания лекарственного препарата. Так, если в 1960-е годы срок разработки составлял 8,1 лет, то в 2005 г. он увеличился до 11,8 лет. В настоящее время стоимость создания оригинального (в российском законодательстве — референтного) лекарственного препарата составляет порядка 1–1,2 млрд долл. (для сравнения: один самолет Боинг 787 стоит 200 млн долл.).
С момента принятия первого руководящего документа — так называемых надлежащих фармацевтических практик — начинается эпоха формирования технических документов и их гармонизация на уровне стран-участниц международных организаций. На сегодняшний день в фармацевтическом правовом поле сформировались следующие своды правил, которые реализуются на национальном уровне:
- GLP — good laboratory praxis — стандарт, направленный на обеспечение согласованности и достоверности результатов лабораторных исследований вне зависимости от места их проведения (впервые в США в 1979 г.);
- GCP — good clinical praxis — стандарт клинических исследований, охватывающий планирование, проведение, завершение, проверку, анализ результа
