автордың кітабын онлайн тегін оқу Инструментальные методы исследований объектов агросферы
С.Л. Белопухов, И.И. Дмитревская, О.В. Елисеева, А.В. Жевнеров
Инструментальные методы исследований объектов агросферы
Учебное пособие
Информация о книге
УДК 542.8(075.8)
ББК 40.1я73
И72
Авторы:
Белопухов С. Л., Дмитревская И. И., Елисеева О. В., Жевнеров А. В.
Рецензенты:
Нефедьева Е. Э., доктор биологических наук, доцент, заместитель заведующего кафедрой «Промышленная экология и безопасность жизнедеятельности» ФГБОУ ВО «Волгоградский государственный технический университет»;
Дорохов А. С., доктор технических наук, профессор, член-корреспондент РАН, заместитель директора по научно-организационной работе ФГБНУ «Федеральный научный агроинженерный центр ВИМ».
Учебное пособие подготовлено в соответствии с рабочей программой ФГОС ВО дисциплины «Инструментальные методы анализа» и состоит из пяти частей, в которых рассмотрены основные физико-химические методы анализа: атомно-эмиссионная спектроскопия (пламенная фотометрия), атомно-абсорбционная спектроскопия (атомно-абсорбционный элементный анализ), абсорбционная спектроскопия в видимом и ультрафиолетовом свете, потенциометрический анализ, хроматография (ионная хроматография). В каждой части представлены теоретические основы методов и лабораторные работы, общее число которых 25. Основная задача практикума — приобретение навыков работы на приборах, изучение методик проведения анализа, обработка полученных результатов. В предисловие включены правила техники безопасности в химической лаборатории. В конце практикума приведены справочные материалы в виде приложений.
Предназначено для студентов, обучающихся в сельскохозяйственных вузах по направлениям подготовки бакалавров 35.03.03 «Агрохимия и агропочвоведение», 35.03.01 «Лесное дело», 05.03.06 «Экология и природопользование», подготовки магистров по направлению 35.04.03 «Агрохимия и агропочвоведение», направленности «Химико-токсикологический анализ объектов агросферы», и рекомендуется научно-методическим советом по сельскому хозяйству для использования в учебном процессе.
УДК 542.8(075.8)
ББК 40.1я73
© Коллектив авторов, 2018
© ООО «Проспект», 2018
Предисловие
Настоящий лабораторный практикум составлен в соответствии с рабочей программой ФГОС ВО дисциплины «Физико — химические методы анализа» для организации учебного процесса студентов, изучающих дисциплину «Физико-химические методы анализа».
В практикум заложены следующие цели:
• практическое освоение студентами научно-теоретических положений изучаемой дисциплины;
• овладение техникой экспериментальных исследований и анализа полученных результатов;
• привитие навыков работы с лабораторным оборудованием, контрольно-измерительными приборами и вычислительной техникой.
При выполнении лабораторных работ студенты должны научиться безопасным приемам обращения с химическими реактивами, приборами и посудой, приобрести навыки в выборе методик анализа и проведении экспериментов и обобщении их результатов, научиться проводить расчеты по полученным данным, оформлять лабораторный журнал, пользоваться научной, учебной и справочной литературой.
В практикуме приведены правила техники безопасности при работе в химической лаборатории, оснащенной приборами и специфическим оборудованием, показаны принципиальные схемы основных приборов и правила работы с ними, а также перечислен необходимый минимум лабораторного оборудования и химической посуды. Материалы практикума знакомят студентов с основными методами физико-химического анализа, формируют представления об их использовании применительно к профессиональной деятельности.
В практикум включены теоретические основы по каждому методу исследований, практическая часть и приложения. Знание теории и навыки, полученные в ходе выполнения лабораторных работ, позволят студентам лучше разобраться в методах инструментальных анализов. Успешному освоению учебного материала способствует самостоятельная подготовка к каждому занятию, которая включает в себя знакомство с теорией по изучаемой теме и проработка методики проведения лабораторной работы.
На лабораторной работе студент должен иметь халат и лабораторный журнал, в котором при подготовке к занятиям составляет краткий конспект теоретического материала по изучаемой теме, методики выполнения лабораторной работы, а также чертит необходимые таблицы. Во время лабораторной работы все записи следует вести в лабораторном журнале шариковой ручкой.
Выполнение каждой лабораторной работы оценивается и фиксируется преподавателем в журнале в конце каждого занятия.
Пропущенные лабораторные работы необходимо отработать только в присутствии преподавателя в кратчайшие сроки после пропуска.
Студенты, имеющие задолженности по лабораторным работам, не допускаются до сдачи коллоквиума.
Правила техники безопасности
Правила техники безопасности при проведении лабораторных работ по курсу «Физико-химические методы анализа» («Инструментальные методы анализа») в целом аналогичны правилам при проведении других работ в лаборатории. Однако в виду специфичности некоторых приборов и оборудования существуют и особые меры предосторожности в зависимости от используемого оборудования. Некоторые типы приборов работают при высоком напряжении, потребляют горючие газы или газы под высоким давлением.
1. На первом занятии до начала выполнения лабораторных работ студенты должны пройти инструктаж по технике безопасности.
2. Студенты должны заходить в лабораторный зал, предварительно сняв верхнюю одежду и надев лабораторный халат. На стол позволяется класть лабораторный журнал и необходимые для работы принадлежности. Не допускается класть на столы сумки или одежду!
3. Длинные волосы должны быть убраны под косынку.
4. Запрещается без разрешения преподавателя или персонала включать или выключать приборы и оборудование — некоторые приборы надлежит выключать, соблюдая определенную последовательность операций.
5. Работать в лаборатории разрешается только в присутствии преподавателя или персонала.
6. В лаборатории запрещается употреблять пишу и напитки.
7. Если в ходе работы требуется использовать концентрированные кислоты или щелочи, то их необходимо использовать только в специально отведенных для этого вытяжных шкафах. При работе с такими веществами необходимо надевать защитные перчатки и очки. Запрещается перемещать концентрированные кислоты или щелочи по лаборатории.
8. Запрещается проводить эксперименты, не описанные в практикуме.
9. При попадании на кожу или в глаза кислот или щелочей следует немедленно промыть место попадания водой и сразу же обратиться за помощью к врачу.
10. Приборы с пламенной атомизацией имеют в верхней части отверстие для выхода отработанных газов. Нельзя наклоняться над ними или дотрагиваться — это может быть причиной ожогов!
11. Легковоспламеняющиеся и другие огнеопасные вещества использовать вдали от нагревательных приборов и под присмотром преподавателя или персонала.
12. Некоторые приборы оснащены газовыми баллонами под высоким давлением. Категорически запрещается самостоятельно открывать или закрывать редукторы на баллонах — это может быть причиной тяжелых ранений!
13. Следует приготавливать (разбавлять) растворы на специально отведенных для этого столах. При разбавлении рядом с прибором вода может попасть под прибор, что может явиться причиной удара электрическим током. Если студент пролил раствор на прибор, следует немедленно сообщить об этом преподавателю или персоналу. Нельзя включать автоматически отключившиеся выключатели (автоматы). Возможно, их срабатывание — следствие неисправности прибора.
14. Разбившуюся посуду следует аккуратно убрать при помощи веника и совка.
15. После окончания работы необходимо убрать свое рабочее место и сдать его преподавателю или персоналу. После этого можно покинуть лабораторию.
Часть 1.
Атомно-эмиссионная спектроскопия (пламенная фотометрия)
1.1. Теоретические основы метода
1.1.1. Сущность метода
Спектральный анализ как метод определения химического состава вещества относится к 1860 г, когда была опубликована работа Кирхгофа и Бунзена: «Химический анализ с помощью наблюдения спектра». К спектральным методам анализа относят методы анализа, основанные на способности атомов или молекул поглощать, испускать или рассеивать электромагнитное излучение.
Благодаря количеству одновременно определяемых элементов, быстроте и достаточно большой точности по их количественному содержанию, эмиссионные и абсорбционные методы спектрального анализа получили широкое распространение в различных областях деятельности человека. Они используются в металлургии и на промышленных предприятиях для анализа металлов и сплавов, в геологии, в археологии, в астрофизике, в аналитической химии, спектральный анализ все чаще находит себе применение в таких областях как экология, пищевая промышленность, сельское хозяйство и медицина. В экологии это анализ илов канализационных отстойников при подготовке технологии их переработки, донных отложений, анализ почв, воды, растений, золы волос животных и человека для оценки зоны экологического поражения. В сельском хозяйстве и пищевой промышленности это анализ почв, кормов, растений, продуктов питания на наличие примесей токсичных элементов и тяжелых металлов. В медицине это диагностика заболеваний, вызванных нарушением обменных процессов по анализу химических элементов в биологических жидкостях, тканях, золе волос, ногтей человека.
Качественный или количественный состав анализируемого вещества определяют, регистрируя поглощение, испускание или рассеивание электромагнитных волн. Атомный спектральный анализ определяет элементный состав образца по атомным (ионным) спектрам испускания и поглощения, молекулярный спектральный анализ — молекулярный состав вещества по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния света.
Для точного исследования спектров необходимы приборы, дающие четкий спектр, т. е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами
Методы спектрального анализа чрезвычайно широко используют в экологии. При этом методы атомного эмиссионного спектрального анализа незаменимы при определении следовых количеств тяжелых металлов в воде, воздухе и почве, а абсорбционную спектроскопию используют для идентификации и установления строения органических соединений, металлорганических соединений и многих неорганических газов
Электромагнитное излучение имеет двойственную природу — волновую и квантовую. Волновая природа объясняет такие явления, как отражение или рассеивание, интерференции, дифракции, преломления. Квантовая природа объясняет процессы поглощения и испускания излучения.
Спектральные методы позволяют анализировать сигнал в различных областях спектра электромагнитных волн, однако для аналитических целей важное значение имеют спектральные методы, использующие излучение оптического диапазона.
Метод атомно-эмиссионной спектроскопии основан на термическом возбуждении свободных атомов и регистрации оптического спектра испускания возбужденных атомов:
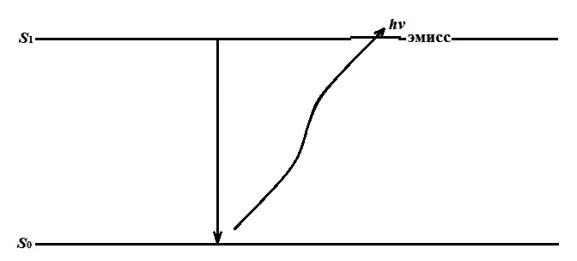
Рис.1.1. Процесс испускания излучения термически возбужденным атомом
Метод эмиссионной пламенной фотометрии является одной из реализаций атомно-эмиссионной спектроскопии. Он основан на измерении интенсивности монохроматического резонансного излучения атомов, возбужденных в пламени. В пламенах при достаточно высоких температурах соединения диссоциируют на атомы, а валентные электроны атомов переходят с основного энергетического уровня на возбужденный. Затем валентные электроны самопроизвольно, спонтанно возвращаются на основной энергетический уровень (рис. 1.1). При этом в соответствии с законом Планка атомы излучают свет строго определенной частоты, которая и называется резонансной. Резонансные частоты придают спектру пламени данного элемента линейчатый вид, т. е. спектр элемента состоит из отдельных, строго определенных узких линий. Иными словами, излучения атомов любого элемента очень характерны и присутствие других элементов в пробе и их атомов в пламени не влияет на положение резонансной линии данного элемента в спектре. Поэтому по интенсивности резонансной линии при определенных условиях можно определять содержание элемента в пробе.
Чтобы обеспечить пропорциональность между интенсивностью свечения пламени и содержанием элементов в пробе, во всем светящемся объеме пламени равномерно распределяют мельчайшие капли раствора. Это делается с помощью распылителя-пульверизатора, который подает аэрозоль пробы вместе с газом-окислителем в смесительную камеру, где аэрозоль, газ-окислитель и горючий газ смешиваются. Из смесительной камеры газы с аэрозолем попадают в пламя горелки. Капли аэрозоля быстро высыхают в нижней части пламени, а образующиеся микрочастицы сухой соли под действием высокой температуры быстро диссоциируют на атомы. Процессы возбуждения атомов и излучения являются еще более быстрыми, и в результате почти весь объем пламени оказывается светящимся.
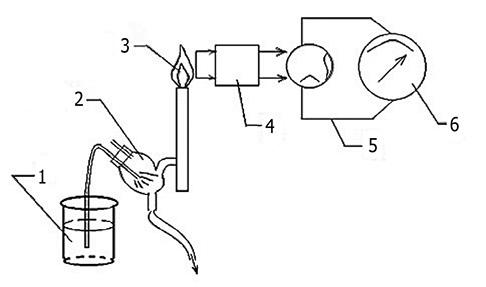
Рис 1.2. Схема пламенного фотометра: 1 — анализируемый раствор; 2 — распылитель; 3 — пламя; 4 — светофильтр, 5 — фотоэлемент; 6 — гальванометр
Излучение пламени с помощью оптической системы пламенного фотометра направляется на монохроматор, который выделяет из спектра пламени резонансную или аналитическую линию элемента. Эта часть излучения далее с помощью фотоэлемента преобразуется в фотоэлектрический ток, который измеряется гальванометром. Принципиальная схема пламенного фотометра представлена на рис. 1.2.
Метод пламенной фотометрии является экспрессным методом анализа, позволяющим определять концентрации элементов с погрешностью до 2–4%.
Чувствительность метода зависит от свойств аналитической линии (ее интенсивности, ширины), состава пробы, качества аппаратуры. Например, натрий можно определять при очень низких его содержаниях — до 0,001 мкг/мл, калий и литий — до 0,01 мкг/мл. Методом пламенной фотометрии можно определять примерно 40 элементов. Но чаще всего его применяют для определения щелочных и щелочноземельных металлов.
1.1.2. Излучение возбужденных атомов
В пределах температур до 3000°С большая часть свободных атомов находится в невозбужденном основном энергетическом состоянии. При столкновении атома с другими частицами — молекулами, ионами, радикалами — энергия переводит один из валентных электронов атома на одну из возбужденных орбиталей, т. е. в более высокое энергетическое состояние. Через короткое время (∼10-8 с) возбужденный атом спонтанно возвращается в основное состояние. Освобождающаяся при этом энергия излучается в виде кванта света. Частота излучения ν, а, следовательно, и длина волны определяются формулой Планка:
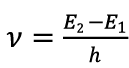
|
, | (1.1) |
где Е2 и E1 — энергия атома соответственно в возбужденном и основном состояниях; h– постоянная Планка; ν– частота излучения.
Частота излучения связана с длиной волны соотношением:
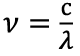
|
, | (1.2) |
где с — скорость света, λ — длина волны.
Источником возбуждения эмиссионных спектров являются различные виды пламени. Пламя — это низкотемпературная равновесная плазма, для которой распределение атомов по подуровням энергии определяется формулой Больцмана:
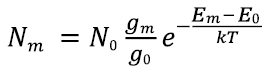
|
, | (1.3) |
где Nm- число атомов в возбужденном состоянии при энергии Еm,N0- число атомов в основном состоянии при энергии Е0,gm и g0 — статистические веса уровня с энергией Emи основного уровня E0; Em — энергия атома в возбужденном состоянии; k– постоянная Больцмана, Т — абсолютная температура пламени.
Относительное число возбужденных атомов невелико и всегда меньше 1%. Основная их часть находится на первом возбужденном уровне, а на втором и последующих возбужденных уровнях атомов очень мало.
Интенсивность спектральной линии выражается уравнением:
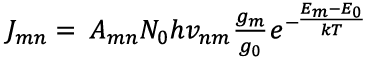
|
, | (1.4) |
где Am — вероятность перехода с возбужденного уровня m на уровень n.
Из уравнения (1.4) видно, что интенсивность спектральной линии в основном зависит от энергии возбуждения уровня Em, концентрации свободных атомов No, температуры T и вероятности перехода Amn. Число свободных и возбужденных атомов в пламени, а значит, и интенсивность спектральной линии пропорциональны концентрации элемента в растворе.
Ближайший к основному энергетический уровень, принято называть резонансным, а спектральную линию, соответствующую переходу с этого уровня на основной или наоборот — резонансной линией данного элемента. Резонансные линии возбуждаются легче других, являются наиболее чувствительными и используются, поэтому как аналитические при установлении малых содержаний определяемых элементов.
1.1.3. Спектральные аналитические характеристики калия, натрия и кальция
В пламенных фотометрах имеются не менее трех светофильтров: для определения калия, натрия и кальция.
Калий определяется по резонансному дублету и ближней инфракрасной области — 766,5 и 769,9 нм. Так как потенциал ионизации калия относительно низок, товгорячих пламенах его атомы ионизированы. Наиболее близкую к линейной градуировке дают низкотемпературные пламена, например, пламя светильный газ–воздух. Так же, как и в случае с натрием, для определения калия применяют фотометры и спектрофотометры.
Для определения натрия используется желтый дублет, состоящий из линий 589,0 и 589,6 нм (рис. 1.3), эти две линии не разделяются на приборах с малой разрешающей способностью. Чувствительность определения натрия очень велика, она повышается с увеличением температуры пламени. Для проведения анализа применяют как фотометры, так и спектрофотометры. Проведению анализа на фотометрах могут помешать литий, кальций и стронций.

Рис. 1.3. Линейчатый спектр излучения натрия
У щелочноземельных элементов эмиссионные спектры сложнее, чем щелочных. Элементы второй группы образуют оксиды с высокой энергией диссоциации. В пламени наряду со спектрами атомов наблюдают спектры молекул типа СаО и радикалов типа СаОН. Кальций определяется по молекулярной полосе с максимумом 622 нм с помощью фотометров. Чувствительность определения Са повышается при применении пламен с высокой температурой.
Типичной особенностью анализа кальция и других щелочноземельных элементов является гасящий эффект — влияние различных катионов и анионов, в присутствии которых понижается интенсивность излучения. Гасящий эффект проявляется в присутствии РO43-, SO42-, Al3+, Fe3+, Мо6+ и др. Он связан с образованием соединений, которые плохо диссоциируют в пламени, например, СаА12O4. Эффект гашения может быть подавлен или снижен введением так называемых специальных реагентов (модификаторов). При определении кальция в присутствии фосфата вводят соли лантана, от влияния алюминия освобождаются введением оксихинолина.
1.1.4. Процессы, происходящие в пламени
Температура пламени это функция от теплотворной способности газовой смеси окислителя и восстановителя. В методе фотометрии пламени применяются различные виды пламени:
|
Восстановитель |
Окислитель |
Температура пламени, 0С |
| Этиловый спирт |
Воздух |
900 |
| Газ городской сети |
Воздух |
1700-1840 |
| Пропан-бутан* |
Воздух |
800-1970* |
| Ацетилен |
Воздух |
2200 |
| Ацетилен |
Кислород |
3100 |
| Ацетилен |
Оксид азота(I) |
3200 |
*Калорийность пропан-бутановой смеси в три раза выше, чем у природного газа (газа городской сети)
При сгорании газовой смеси образуются коротко живущие, неустойчивые молекулы и радикалы, от которых при столкновении энергия передается возбужденным атомам определяемого элемента. При применении более горячих пламен интенсивность резонансных линий может быть повышена.
При распылении раствора в пламени температура немного понижается, и тем больше, чем выше скорость распыления. Так как структура пламени сложна, результаты пламенно-фотометрического определения зависят от того, какая зона пламени проецируется на щель спектрального прибора.
Превращение раствора пробы в атомизированную плазму является многостадийным и сложным, хотя время пребывания пробы в пламени не превышает тысячной доли секунды. Одни и те же параметры на каждой стадии атомизации могут приводить к противоположным эффектам, улучшающим или ухудшающим общие показатели анализа.
В пламени происходят следующие процессы:
Гомогенный исходный раствор (проба)
↓ 1) Распыление в смесителе горелки
Аэрозоль с каплями близких размеров
↓ 2) Испарение растворителя (десольватация)
Сухой аэрозоль — мелкие твердые частицы пробы
↑↓ 3) Испарение и конденсация твердой фазы в пламени
Молекулярные пар соединений анализируемого элемента
↑↓ 4) Атомизация и ассоциация молекул, радикалов, ионов
Атомный пар анализируемого элемента
↓ 5) Возбуждение свободных атомов
Возбужденные атомы анализируемого элемента
6) Излучение возбужденных атомов
Влияние различных параметров на отдельные стадии в пламени.
1. Распыление пробы зависит от ее вязкости, поверхностного натяжения раствора, радиуса и длины капилляра, подающего раствор в пульверизатор, от расхода газа-окислителя (чаще всего воздуха).
2. Испарение растворителя (десольватация) зависит от размера капель аэрозоля, природы растворителя (его испарения) и температуры в активной зоне пламени.
3. Испарение образовавшихся твердых частиц, приводящее к образованию молекулярного газа, зависит от температуры пламени. При высоком содержании в пробах посторонних веществ могут образовываться нелетучие твердые частицы новых соединений. Если эти твердые нелетучие соединения не содержат определяемый элемент, они могут уменьшать испаряющую поверхность микрочастиц.
4. Атомизация анализируемого элемента, т. е. диссоциация молекулярного пара на атомы, образование атомного пара зависят от температуры пламени и концентрации молекулярных форм элементов. Степень атомизации определяемого элемента снижается за счет ассоциации атомов в молекулы исходного молекулярного пара или за счет образования из атомов и других частиц новых труднолетучих соединений. Такими соединениями могут быть, например, оксиды, гидроксиды, силикаты, фосфаты. При низких потенциалах ионизации определяемых элементов происходит ионизация атомизированного элемента, которая, естественно, также снижает содержание атомов в единице объема пламени.
5. Переход свободных атомов определяемого элемента из основного энергетического состояния в возбужденное регламентируется, прежде всего, температурой и концентрацией свободных атомов. Доля возбужденных атомов всегда очень мала по сравнению с долей атомов в основном энергетическом состоянии.
Стадии 3, 4, 5, несмотря на свою скоротечность, являются термодинамически равновесными. Прямые и обратные процессы каждой стадии протекают в «холодной» плазме пламени настолько быстро, что концентрации всех атомных и молекулярных частиц можно было бы найти с помощью соответствующих констант равновесия. То же справедливо и для частиц, образующихся в окислительно-восстановительных реакциях в процессе сгорания горючего газа в газе-окислителе.
Общая картина атомизации и поведения определяемого элемента в пламени слишком сложны, чтобы ее можно было количественно описать и сделать метод пламенной фотометрии абсолютным, т. е. не требующим калибровки. Существует много причин, препятствующих этому. Распыление раствора в пламени снижает его температуру, причем тем больше, чем выше скорость распыления. Структура пламени сложна, различные его части имеют разную температуру и поэтому результаты пламенно-фотометрических определений зависят от того, какая зона пламени проецируется на щель перед фотоэлементом — датчиком сигнала. Особенно осложняется общая картина присутствием в пробах мешающих, часто неизвестных по химической природе веществ.
Количественный учет влияния всех процессов в пламени — задача практически неразрешимая. Непосредственно по измеренному значению интенсивности спектральной линии определить концентрацию элемента в растворе нельзя. Однако при стабильных условиях работы прибора с помощью растворов с заранее известной концентрацией определяемого элемента можно установить зависимость между величиной сигнала на приборе и концентрацией элемента в растворе, то есть, можно произвести градуировку прибора.
1.1.5. Методы определения концентрации вещества в растворе
Независимо от выбранного способа определения неизвестной концентрации вещества в растворе необходимо провести градуировку прибора в той области концентраций, которая представляет интерес для данной группы проб.
Метод градуировочного графика. В этом методе готовят серию эталонных растворов с известной концентрацией определяемого элемента. Для каждого раствора измеряют интенсивность излучения пламени и либо записывают соответствующее показание прибора — гальванометра, либо эти данные сохраняются в памяти прибора. После этого приступают к построению градуировочного графика (рис.1.4) по оси абсцисс откладывают численные значения концентраций эталонных растворов, а по оси ординат — показания гальванометра. Наносят на график экспериментальные точки и соединяют их линией. При этом масштабы по обеим осям выбирают такими, чтобы угол между линией, полученной в результате соединения экспериментальных точек, и осью абсцисс составлял примерно 45°. При этом чувствительность методики максимальна, т.к. коэффициент чувствительности, являясь тангенсом угла наклона градуировочного графика к оси абсцисс ближе к единице.
Зависимость интенсивности излучения от концентрации раствора имеет линейный вид лишь в небольшом диапазоне концентраций. Желательно выбрать прямолинейный участок градуировочной кривой для большей точности.
Градуировочная кривая может отличаться от прямой линии, даже если выбрана область концентраций, где величина интенсивности спектральной линии линейно зависит от концентрации. Причиной этого может быть отсутствие пропорциональности между величиной фототока и показаниями прибора, освещенностью и величиной фототока и др. Нелинейная, но надежно построенная градуировочная кривая может быть использована для определения концентраций, хотя точность определений в таких случаях несколько снижается.
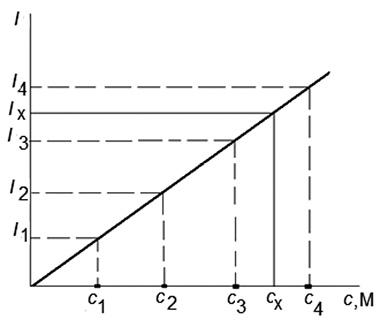
Рис. 1.4.
...