автордың кітабын онлайн тегін оқу Физическая и коллоидная химия. Задачи и упражнения
С. Л. Белопухов, И. Б. Немировская, В. Т. Семко
Физическая и коллоидная химия. Задачи и упражнения
Учебное пособие
Под общей редакцией
профессора С. Л. Белопухова
Информация о книге
УДК 541.1(075.8)
ББК 24.5я73
Ф48
Авторы: Белопухов С. Л., кандидат химических наук, доктор сельскохозяйственных наук, профессор, заведующий кафедрой физической и органической химии Российского государственного аграрного университета — МСХА имени К. А. Тимирязева, заслуженный изобретатель Российской Федерации, лауреат премии Правительства Российской Федерации в области науки и техники;
Немировская И. Б., кандидат химических наук, доцент кафедры физической и органической химии Российского государственного аграрного университета — МСХА имени К. А. Тимирязева;
Старых С. Э., кандидат биологических наук, доцент кафедры физической и органической химии Российского государственного аграрного университета — МСХА имени К. А. Тимирязева;
Семко В. Т., кандидат технических наук, доцент кафедры физической и органической химии Российского государственного аграрного университета — МСХА имени К. А. Тимирязева;
Шнее Т. В., кандидат биологических наук, доцент кафедры физической и органической химии Российского государственного аграрного университета — МСХА имени К. А. Тимирязева;
Федорова Т. А., кандидат биологических наук, доцент кафедры физической и органической химии Российского государственного аграрного университета — МСХА имени К. А. Тимирязева.
Рецензенты: Боев В. И., доктор химических наук, профессор РГАУ-МСХА имени К. А. Тимирязева;
Верхотуров В. В., доктор биологических наук, профессор Иркутского государственного технического университета.
Под общей редакцией: профессора Белопухова С. Л.
В пособии приведены задачи, упражнения и примеры решения задач по основным разделам физической и коллоидной химии. Учебное пособие составлено в соответствии с программой дисциплины «Физическая и коллоидная химия» для бакалавров, обучающихся в сельскохозяйственных вузах страны, и отражает современное развитие физической и коллоидной химии. Каждый раздел содержит краткое теоретическое введение, примеры решения типовых задач, задачи и упражнения для самостоятельного решения.
УДК 541.1(075.8)
ББК 24.5я73
© Коллектив авторов, 2015
© ООО "Проспект", 2015
Предисловие
При изучении курса «Физическая и коллоидная химия» в сельскохозяйственном вузе большое значение имеет приобретение навыков в решении расчетных задач по основным разделам дисциплины. Этот навык впоследствии используется и закрепляется в специальных курсах «Агрохимия», «Почвоведение», «Защита растений», «Экология», «Биохимия», «Биотехнология», «Технология переработки продукции животноводства и растениеводства» и других при расчете доз удобрений, концентраций рабочих растворов и баковых смесей пестицидов и т. д.
Предлагаемый сборник задач и упражнений составлен в соответствии с программой дисциплины, Федеральными государственными образовательными стандартами. В каждом разделе сборника содержатся задачи и упражнения с использованием биологических объектов, примеры из практики сельскохозяйственного производства. В начале каждого раздела сборника приведены примеры с подробным описанием хода решения. В приложении приведены таблицы, содержащие физико-химические характеристики, необходимые для решения задач. Размерности физических величин даны в Международной системе единиц (СИ).
Для приобретения навыков решения задач по теоретическому курсу физической и коллоидной химии студенты выполняют домашнее задание по следующим темам.
1. Химическая термодинамика.
2. Электрическая проводимость растворов электролитов.
3. Равновесные электродные потенциалы и электродвижущая сила.
4. Коллоидные системы, методы их получения и свойства. Коагуляция коллоидов.
5. Растворы высокомолекулярных соединений (ВМС) и их свойства.
Для самостоятельного решения и выполнения домашнего задания приводится список рекоменуемой литературы.
Выполнение задания является необходимым условием допуска студента к зачету или экзамену по курсу физической и коллоидной химии. Контроль качества выполнения задания определяется преподавателем, оценка соответствует числу правильно решенных задач. Если студент не получил положительной оценки, он должен доработать домашнее задание и пересдать его.
Выполнять домашнее задание следует в отдельной тетради, приводя письменное решение каждой задачи и давая полный ответ на поставленный теоретический вопрос.
Для более качественного выполнения домашнего задания в учебном пособии разбираются основополагающие элементы и упражнения изучаемых разделов и приводится решение типовых задач.
Химическая термодинамика. Термохимия
Химическая термодинамика является частью физической химии и изучает закономерности превращения энергии при взаимодействии системы и внешней среды, то есть общие закономерности превращения одного вида энергии в другой. Эти процессы описываются тремя законами (началами).
Первый закон (начало) термодинамики устанавливает взаимосвязь между изменением внутренней энергии системы, теплотой и работой процесса:
ΔU = Q + W,
где ΔU – изменение внутренней энергии; Q – тепловой эффект; W – работа.
На практике принято рассматривать изохорные процессы (проходят при постоянном объеме, V = const) и изобарные (протекают при постоянном давлении, P = const).
В первом случае: Qv = ΔU, так как ΔV = 0, то есть теплота изохорного процесса равна изменению внутренней энергии системы.
Во втором случае: Qp = ΔH, так как согласно первому началу термодинамики
ΔU = Qp + W, отсюда
Qp = ΔU – W,
W = ‒p ∙ (V2 – V1).
Знак «‒» характеризует то, что система совершает работу против сил внешней среды.
Qp = U2 – U1 + p(V2 – V1)
Qp = (U2 + pV2) – (U1 + pV1),
где U + p ∙ V – энтальпия, обозначается Н, тогда
Qp = H2 – H1 = ΔH.
Теплота (независимо от вида процесса) может выражаться в калориях (кал) или джоулях (Дж).
Калорией называется количество теплоты, необходимое для повышения температуры 1 г H2O с 14,5 до 15,5 °С.
Джоуль – это работа, совершенная силой в 1 Ньютон на пути 1 метр.
1 калория равна 4,18 Джоуля.
Для реакций, протекающих в газовой фазе, на основании того, что Qp = ΔH, а Qv = ΔU и закона Джоуля (который утверждает, что внутренняя энергия идеального газа зависит только от температуры и не зависит от объема и давления) установлено соотношение:
Qp = Qv + ΔnRT,
где Δn = nпрод – nреаг, то есть Δn – разница между числом молей образовавшихся газообразных продуктов реакции и числом молей газообразных реагентов.
Для реакций в конденсированных фазах принимают: Δn = 0, ΔU = ΔH, Qv = Qp.
Таким образом, первый закон термодинамики позволяет дать только энергетическую оценку процесса, но не дает никаких указаний на то, в каком направлении процесс будет протекать самопроизвольно.
Для ответа на вопрос о направлении самопроизвольного протекания процесса (химической реакции) существует второй закон (начало) термодинамики, использующий понятие энтропии (S). Для равновесных (обратимых) процессов энтропия рассчитывается по уравнению:
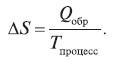
Отсюда следует, что изменение энтропии в процессе равно теплоте процесса, деленной на температуру, при которой этот процесс происходит. В случае обратимого процесса ΔS = 0, то есть энтропия обратимого процесса – величина постоянная. Для необратимого процесса (самопроизвольного) изменение энтропии выразится как
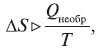
то есть ΔS > 0 при Т = const.
Изменение энтропии при изотермическом расширении n моль идеального газа можно определить по формуле:
ΔS = nR × ln(V2/V1) или
ΔS = nR × ln(P2/P1).
В изолированной системе самопроизвольно могут совершаться только такие процессы, в результате которых энтропия системы возрастает. Процесс может идти самопроизвольно до достижения максимального значения энтропии. Энтропия системы не может уменьшаться.
Третий закон термодинамики утверждает, что энтропия чистых веществ, существующих в виде идеальных кристаллов, при абсолютном нуле равна нулю. Этот закон можно записать в виде уравнения следующим образом:
ΔS = 0 при Т = 0 К.
Значение третьего начала термодинамики заключается в том, что на его основе можно вычислить абсолютную энтропию вещества, если известны его химический состав и строение.
Часть химической термодинамики, которая изучает химические реакции с точки зрения тепловых эффектов, которыми сопровождаются эти реакции, называется термохимией. Основным законом термохимии является закон Гесса. Он утверждает, что тепловой эффект химической реакции зависит от вида и состояния конечных продуктов и исходных реагентов, но не зависит от пути протекания реакции (то есть не зависит oт количества промежуточных стадий). Математическое выражение закона Гесса имеет следующий вид:
(ΔQ)ΔH298 = ΣΔH0f(продукты) – ΣΔH0f(реагенты).
В данном случае ΔН0298 – стандартная энтальпия химической реакции (тепловой эффект химической реакции при постоянном давлении QP); ∆H0f(продукты) – стандартная молярная энтальпия образования продуктов реакции (реагентов).
На основе закона Гесса, используя значения стандартных энтальпий образования соединений, которые имеются в химических справочниках, можно теоретически вычислить тепловой эффект любой химической реакции, не проводя ее экспериментально.
Решение типовых задач
Пример 1. Рассчитайте тепловой эффект реакции гидратации этилена.
СН2 = СН2 + Н2О(ж) = СН3СН2ОН,
если
ΔH0f (C2H5OH) = –66,35 ккал/моль
ΔН0f (СН2 = СН2) = 12,50 ккал/моль
ΔН0f (Н2О(ж)) = –68,32 ккал/моль
Решение:
ΔH298 = ΣΔH0f(продукты) – ΣΔH0f(исходные вещества)
ΔH298 = –66,35 – 12,50 – (–68,32) = –10,55 ккал/моль
или –10,55 ккал/моль = –44,1 кДж/моль.
Пример 2. Рассчитать энтропию обратимого превращения 1 моль воды в пар при температуре кипения.
Решение:
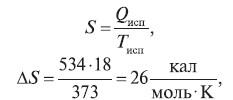
где 18 – молекулярная масса воды; 534 кал/г – скрытая теплота испарения 1 г воды (обратимый процесс); 373 К – температура кипения воды.
Пример 3. Один моль льда тает при температуре 0 °С. Удельная теплота фазового перехода твердое тело–жидкость составляет 79 кал/г. Рассчитайте энтропию фазового перехода твердое тело–жидкость.
Решение:
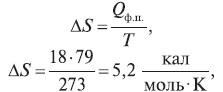
где 18 – молекулярная масса воды, 273 – температура таяния льда.
Пример 4. Расчет теплового эффекта реакции по стандартным теплотам образования реагирующих веществ.
Определите количество теплоты, выделяющееся при гашении 100 кг извести водой, если стандартные теплоты образования реагирующих веществ (кДж/моль) равны:
(∆Н0298)СаО(т) = –635,1
(∆Н0298)Са(ОН)2(т) = –986,2
(∆Н0298)Н2О(ж) = –285,84
Решение:
СаО(т) + Н2О(ж) = Са(ОН)2(т)
(ΔH0298) = Σ(ΔH0298)продукты реакции – Σ(ΔH0298)исходные вещества
(ΔH0298) = –986,2 – (–635,1 – 285,84) = –65,35 кДж/моль.
Вывод: реакция экзотермическая.
Расчет на 100 кг: составляем пропорцию
56 г CaO (1 моль) ……(–65,35) кДж/моль
100000 г Ca Х
Пример 5. Расчет теплового эффекта реакции по стандартным теплотам сгорания реагирующих веществ.
Определите тепловой эффект реакции синтеза акриловой кислоты:
СН ≡ СН(г) + СО(г) + Н2О(ж) → СН2=СН–СООН(ж),
если стандартные теплоты сгорания ацетилена, оксида углерода и акриловой кислоты соответственно равны (кДж/моль): –1299,63; –282,50; –1370,00.
Решение:
(ΔH0298) = Σ(ΔH0f)сгорания реагирующих веществ – Σ(ΔH0f)сгорания продуктов реакции
(ΔH0298) = –1299,63 – 282,50 + 1370,00 = –211,13 кДж/моль.
Реакция экзотермическая.
Пример 6. Расчет стандартной теплоты образования веществ.
Вычислите стандартную теплоту образования сахарозы, если известен тепловой эффект реакции (–5694 кДж):
С12H22O11 + 12O2 → 12CO2 + 11H2O(ж) – 5694 кДж.
Решение:
(ΔH298) = Σ(ΔH0f)продукты реакции – Σ(ΔH0f)исходные вещества.
Сахароза является исходным реагирующим веществом, поэтому
Σ(ΔH0f)реагенты = Σ(ΔH0298)продукты реакции – (ΔH298)
(ΔH0298)C12H22O11 = 12 · (–393,51) + 11 · (–285,84) + 5694 = –222,4 кДж/моль.
Пример 7. Вычисление изменения энергии Гиббса. Определение возможности протекания процесса по величине изменения энергии Гиббса.
Дать ответ о возможности протекания следующей реакции:
SiO2(к) + 2NaOH(р) = Na2SiO3(к) + H2O(ж),
если
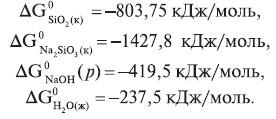
Можно ли выпаривать щелочь в стеклянном сосуде?
Решение:
Изменение энергии Гиббса ∆G0298 реакции равно:
ΔG298 = ΣΔG0f продуктов реакции – ΣΔG0f исходных веществ;
ΔG298 = (–1427,8 – 237,5) – (–803,75 – 419,5 · 2) = –22,55 кДж/моль;
ΔG298 = –22,55 кДж/моль.
Таким образом, ∆G < 0. Следовательно, данная реакция возможна. Щелочь нельзя выпаривать в стеклянном сосуде, так как в состав стекла входит SiO2.
Пример 8. Определите тепловой эффект реакции:
Al2O3корунд + 3SO3газ = Al2(SO4)3 + ΔU,
если реакция протекает в автоклаве при V = const, а тепловой эффект при P = const равен –573,4 кДж.
Решение:
По тепловому эффекту реакции при постоянном давлении определим тепловой эффект при постоянном объеме по уравнению ΔH = ΔU + ΔnRT. Изменение числа молей газообразных продуктов реакции Δn = –3, так как Al2O3 и Al2(SO4)3 твердые вещества:
ΔU298 = ΔH0f – ΔnRT =
= –573,4 + 3 × 8,3143 × 103 × 298 = –566,0 кДж.
Пример 9. Рассчитать энтропию процесса изотермического расширения 1 моля идеального газа от 1 до 100 л при температуре 17 °С.
Решение:
ΔS = nR × ln(V2/V1) =
= 1 × 1,987 × 2,303 lg100 = 9,15 кал/моль × град.
Задачи и упражнения
1. Рассчитать стандартную энтальпию реакции СaO + H2O = Ca(OH)2, если ΔH0(CaO) = –635,5 кДж/моль, ΔН0Ca(OH)2 = –986,2 кДж/моль, ΔH0(H2O)= –241,82 кДж/моль.
2. Найдите стандартную энтальпию реакции CO + Cl2 = COCl2, если ΔH0(CO) = –110,53 кДж/моль, ΔH0(COCl2) = –482,00 кДж/моль.
3. Найдите стандартную энтальпию реакции 2NO + O2 = 2NO2, если ΔН0(NO2) = –33,69 кДж/моль, ΔH0(NO) = 90,37 кДж/моль.
4. Определите изменение энтропии плавления льда. Обратимый процесс при Р = const. ΔНпл. = 1436,3 кал/моль.
5. Найдите изменение энтропии в реакции: 2СH3OH + 3O2 = 2CO2 + 4H2O, если S0(H2O) = 188,78 Дж/(моль·К), S0(CO2) = 213,65 Дж/(моль·К), S0(O2) = 205,18Дж/(моль·К), S0(CH3OH)=125,7 Дж/(моль·К).
6. Рассчитать калорийность сахарозы, по реакции: C12H22O11 + 12O2 = 12CO2 + 11H2O, если ΔH0(H2O) = –241,82 кДж/моль, ΔH0(CO2) = –393,51 кДж/моль, ΔH0(C12H22O11) = –482,0 кДж/моль.
7. Сколько тепла выделяется при сжигании 100 л этилена (н. у.), если пар превращается в воду. C2H4(г) + 3O2(г) → 2CO2(г) + 2H2O(ж). ΔH0(C2H4) = –13,6 ккал/моль, ΔH0(CO2(г)) = 97,7 ккал/моль, ΔH0(H2O(ж)) = 68,4 ккал/моль.
8. Найдите изменение энтропии в реакции 4NH3 + 5O2 = 4NO + 6H2O, если S0(H2O) = 188,78 Дж/(моль·К), S0(NO) = 210,62 Дж/моль, S0(O2) = 205,18 Дж/моль, S0(NH3) = 192,5 Дж/(моль·К).
9. Вычислите стандартную энтропию плавления льда, если ΔH0 плавления равна 6,0 Дж/моль.
10. Реакция образования хлористого водорода из хлора и водорода H2 + Cl2 = 2HCl + 43,8 ккал. Сколько тепла выделяется при взаимодействии 1 л хлора с водородом?
11. Сколько тепла выделится при восстановлении 8 г оксида меди водородом? CuO + H2 = Cu + H2O(ж); ΔH0(CuO) = 34,9 ккал/моль, ΔH0(H2O) = 68,4 ккал/моль.
12. Вычислить изменение стандартной энтальпии образования аммиака, если ΔS0(N2(г) =192 Дж/К·моль, ΔS0(H2(г) = 131 Дж/К·моль, ΔS0(NH3(г)) = 193 Дж/К·моль.
13. Определите теплоту образования CaCO3, если CaCO3 = CaO + CO2 – 4,7 кал. ΔH0(CO2(г)) = 97,7 ккал/моль, ΔH0(CaO) = 34,9 ккал/моль.
14. При сгорании щавелевой кислоты в калориметре выделяется 2,81 кДж/г. Рассчитайте ΔH при сгорании 1 моля щавелевой кислоты при температуре 25 °С.
15. Определите, сколько тепла выделяется при получении 300 г метафосфорной кислоты из фосфорного ангидрида по реакции P2O5 + H2O = HPO3 + Q, если ΔH0(P2O5) = 370 ккал/моль, ΔH0(HPO3) = 226,2 ккал/моль, ΔH0(H2O(ж)) = 68,4 ккал/моль.
16. При сжигании 3,27 г цинка в калориметрической бомбе выделилось 17,35 кДж. Определите теплоту образования ZnO.
17. Определите тепловой эффект реакции гидратации этилена, если ΔH0(C2H5OH) = –66,35 ккал/моль, ΔH0(C2H4) = +12,5 ккал/моль, ΔH0(H2O(ж)) = –68,4 ккал/моль.
18. Определите теплоту образования хлористого аммония, исходя из реакции: NH3 + HCl = NH4Cl + 42,9 ккал, если ΔH0(NH3) = 11,0 ккал/моль, ΔH0(HCl) = 21,9 ккал/моль.
19. Найдите изменение энтропии в реакции 4NH3 + 5O2 = 4NO + 6H2O, если S0(H2O) = 188,78 Дж/(моль·К), S0(NO) = 210,62 Дж/(моль·К), S0(O2) = 205,18 Дж/(моль·К), S0(NH3) = 192,5 Дж/(моль·К).
20. При сгорании масляной кислоты в калориметре выделяется теплота 2,88 кДж/г. Рассчитайте ΔH при сгорании 1 моля масляной кислоты при температуре 25 °С.
21. Найдите изменение энтропии в реакции CH4 + 2O2 = CO2 + 2H2O при стандартных условиях, если S0(H2O) = 188,78 Дж/(моль·К), S0(CO2) = 213,65 Дж/(моль·К), S0(CH4) = 219,4 Дж/(моль·К), S0(O2) = 205,18 Дж/(моль·К).
22. Рассчитате энтропию фазового перехода твердое тело–жидкость. Удельная теплота ΔH0пл. = 331,9 Дж/г. Температура плавления 1 моль вещества равна 0 °С.
23. При взаимодействии 2,1 г металлического железа с серой выделилось 3,64 кДж. Рассчитайте стандартную энтальпию образования 1 моль сульфида железа.
24. Чему равна энтропия плавления льда, если удельная теплота плавления равна 333,6 Дж/г?
25. Термохимическое уравнение реакции горения фосфора 4P + 5O2 = 2P2O5 + 3010 кДж. Сколько теплоты выделяется при сгорании 100 г фосфора?
26. Рассчитайте стандартную энтальпию реакции CaO + H2O = Ca(OH)2, если ΔH0(CaO) = –635,5 кДж/моль, ΔH0(Ca(OH)2) = –986,2 кДж/моль, ΔH0(H2O) = –241,82 кДж/моль.
27. Чему равно изменение свободной энергии в реакции Cu2+ + Zn = Cu + Zn2+, протекаемой в элементе Даниэля-Якоби, ЭДС которого 1,1 вольта? 1 джоуль = 0,239 кал.
28. Найдите изменение энтропии в реакции 2C2H2 + 5O2 = 4CO2 + 2H2O, если S0(H2O) = 188,78 Дж/(моль·К), S0(CO2) = –213,65 Дж/(моль·К), S0(C2H2) = 200,8 Дж/(моль·К), S0(O2) = 205,18 Дж/(моль·К).
29. При сжигании щавелевой кислоты в калориметре выделяется 2,81 кДж/г. Рассчитайте ΔH при сгорании 3 моль щавелевой кислоты при температуре 25 °С.
30. Определите, сколько тепла выделяется при получении 900 г метафосфорной кислоты из фосфорного ангидрида P2O5 + H2O = HPO3 + Q, если ΔH0(P2O5) = 1546,6 кДж/моль, ΔH0(HPO3) = 945,5 кДж/моль, ΔH0(H2O(ж)) = 285,9 кДж/моль.
31. При сжигании 6,54 г цинка в калориметрической бомбе выделилось 34,7 кДж. Определите теплоту образования ZnO.
32. При сжигании в калориметрической бомбе 1,753 г сахарозы температура повышается на 2,907 °С. ΔН сгорания сахарозы равно 1349,7 ккал/моль. Чему равно водяное число калориметра?
33. Чему равна теплота сгорания уксусной кислоты при температуре 25 °С до H2O(ж) и CO2(г), если стандартная энтальпия образования ΔH0(CH3COOH) = –486,6 кДж/моль; ΔH0(CO2) = –393,3 кДж/моль; ΔH0(H2O) = –285,5 кДж/моль.
34. Определите стандартную энтальпию реакции перехода олова из одной аллотропической формы в другую, если ΔH0(олово белое) = –581,0 кДж/моль, ΔH0(олово серое) = –583,5 кДж/моль.
35. Рассчитайте тепловой эффект реакции C2H4 + H2O = C2H5OH, если ΔH0(C2H5OH) = –277,3 кДж/моль, ΔH0(H2O(ж)) = –285,6 кДж/моль, ΔH0(C2H4) = +52,3 кДж/моль.
36. Рассчитайте энтропию обратимого превращения 1 моль воды в пар при температуре кипения. Теплота испарения 1 г воды составляет 2232,1 Дж.
37. Рассчитайте стандартную энтальпию образования ацетилена, если C2H2(г) + 21/2O2(г) → 2СO2(г) + H2O(ж) – 1300 кДж, если ΔH0(H2O) = –286 кДж/моль, ΔH0(CO2) = –394 кДж/моль.
38. Рассчитайте энтропию фазового перехода твердое тело–жидкость. ΔH0пл = 309,3 Дж/моль. Температура плавления 1 моль вещества равна 0 °С.
39. Рассчитайте стандартную энтропию реакции 2NO + O2 = 2NO2, если ΔH0(NO2) = –33,69 кДж/моль; ΔH0(NO) = 90,37 кДж/моль.
40. При взаимодействии 4,2 г железа с серой выделилось 7,27 кДж. Рассчитайте стандартную энтальпию образования 1 моль сульфида железа (II).
41. Вычислите изменение энтальпии при превращении воды в пар, если скрытая теплота парообразования равна 2,25 кДж/г.
42. Определите тепловой эффект химической реакции CH4 + 2O2 = CO2 + 2H2O, если ΔH0(CO2(г)) = 408,4 кДж/моль, ΔH0(H2O(г)) = 241,6 кДж/моль, ΔH0(C4H(г)) = 90,7 кДж/моль.
43. Чему равна теплота сгорания уксусной кислоты при температуре 25 °С до H2O(ж) и CO2(г), если ΔH0(CH3COOH) = –695,5 кДж·моль–1, ΔH0(CO2(г)) = –393,3 кДж·моль–1 и ΔH0(H2O(ж)) = –285,5 кДж·моль–1.
44. Определите теплоту образования азота, исходя из уравнения реакции C + 2N2O = CO2 + 2N2 + 556,3 кДж, если ΔH0(CO2(г)) = 408,3 кДж/моль.
45. Теплота сгорания н-гентана при V = const и температуре 25 °С, протекающая согласно реакции C7H16(ж) + 11O2(г) = 7CO2(г) + 8H2O(ж), равна –4802 кДж·моль-1. Сколько тепла поглощается, если давление в системе остается постоянным (P = const)?
46. Теплота сгорания 1 г глюкозы в организме составляет 17,15 кДж. Рассчитайте количество теплоты, поступающее в живой организм при сгорании 1 моль глюкозы.
47. Рассчитайте стандартную энтальпию реакции 6С(г) + 6Н(г) = С6Н6, если ΔH0(C6H6) = 82,8 кДж·моль–1, ΔH0(C(г)) = 717,7 кДж·моль–1, ΔH0(H(г)) = 217,8 кДж·моль–1.
48. Рассчитайте изменение энтропии при испарении 1 моль воды, если удельная теплота кипения равна 2,3 кДж/г.
49. Рассчитайте тепловой эффект реакции сгорания гептана при P = const и температуре 25 °С, если ΔH0(C7H16(ж)) = +1148,9 ккал/моль, ΔH0(CO2(г)) = +97,7 ккал/моль, ΔH0(H2O(ж)) = +68,4 ккал/моль.
50. Определите теплоту образования фосфористого водорода, исходя из уравнения 2PH3 + 4O2 = P2O5 + 3H2O(ж) + 2452 кДж, если ΔH0(P2O5) = 1546,6 кДж/моль, ΔH0(H2O) = 285,9 кДж/моль.
51. Рассчитайте стандартную энтальпию реакции CaO + H2O = Ca(OH)2, если ΔH0(CaO) = –635,5 кДж/моль, ΔH0(Ca(OH)2) = –986,2 кДж/моль, ΔH0(H2O) = –241,8 кДж/моль.
52. Термохимическое уравнение реакции горения фосфора имеет вид: 4P + 5O2 = 2P2O5 + 3010 кДж. Какое количество теплоты выделяется при сгорании 100 г фосфора?
53. Чему равна энтропия плавления льда, если удельная теплота плавления равна 333,6 Дж/г?
54. Рассчитайте изменение энтропии при испарении 1 моль воды, если теплота кипения (ΔHкип.) равна 2,26 кДж/моль.
55. Вычислите, сколько тепла выделяется при получении 1200 г метафосфорной кислоты из фосфорного ангидрида по реакции P2O5 + H2O = HPO3 + Q, если ΔH0(P2O5) = 1547 кДж/моль, ΔH0(HPO3) = 945,5 кДж/моль, ΔH0(H2O) = 285,9 кДж/моль.
56. Определите теплоту сгорания сероуглерода в сооответствии с реакцией СS2 + 3O2 = CO2 + 2SO2 + 1080 кДж, если ΔH0(CO2(г)) = 408,3 кДж/моль, ΔH0(SO2(г)) = 289,7 кДж/моль.
57. Определите стандартную энтальпию реакции перехода олова из одной аллотропической формы в другую, если ΔH0(олово белое) составляет –581 кДж/моль, ΔH0(олово серое) = –583,5 кДж/моль.
58. При сжигании в калориметрической бомбе 0,6 г сахарозы температура повышается на 1 °С. ΔH0 сгорания сахарозы равна 5641,7 кДж/моль. Чему равно водяное число калориметра?
59. При сгорании этановой кислоты в калориметре выделяется теплота 2,17 кДж/г. Рассчитайте ΔH при сгорании 1 моля этановой кислоты при температуре 25 °C.
60. Вычислите изменение стандартной энергии Гиббса при температуре 1000 К для реакции MgCO3(тв) → MgO(тв) + CO2(г), если ΔH0(MgCO3)= –1113 кДж/моль, ΔS0(MgCO3) = +66 Дж/(моль·К), ΔH0(MgO) = –602 кДж/моль, ΔS0(MgO) = +27 Дж/(моль·К), ΔH0(CO2) = –349 кДж/моль, ΔS0(CO2) = +214 Дж/(моль·К).
61. Вычислите изменение стандартной энтропии образования аммиака, если ΔS0(N2) = 192 Дж/(моль·К), ΔS0(H2) = 131 Дж/(моль·К), ΔS0(NH3) = 193 Дж/(моль·К).
62. Вычислите ∆Н0298 хлорида аммония, если для реакции
NH3(г) + HCl(г) = NH4Cl(т)
∆Н0298 = –176,9 кДж/моль.
63. Теплота сгорания глюкозы равна 2802,04 кДж/моль, теплота сгорания этанола равна –1370,68 кДж/моль. Вычислите тепловой эффект биохимического процесса брожения глюкозы, который описывается уравнением вида: С6Н12О6 = 2С2Н5ОН + 2СО2.
64. Вычислите стандартный тепловой эффект реакции: Fe2O3(т) + 2Al(т) = 2Fe(т) + Al2O3(т). Стандартная теплота образования Al2O3(т) составляет –1670 кДж/моль, а Fe2O3(т) составляет –821 кДж/моль.
65. При растворении 16 г карбида кальция (СаС2) в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования гидроксида кальция Са(ОН)2.
66. Тепловой эффект реакции SO2(г) + 2H2S(г) = 3S(ромб) + 2H2O(ж) равен –234,50 кДж. Определите стандартную теплоту образования сероводорода H2S.
67. Окисление аммиака протекает по уравнению: 4NH3(г) + 3О2(г) = 2N2 + 6H2O(ж) + 1528 кДж. Определите стандартную теплоту образования NH3(г) и гидроксида аммония (NH4OH), если теплота растворения NH3(г) в воде равна –34,65 кДж.
68. Восстановление диоксида свинца водородом протекает по уравнению: PbO2 + H2 = PbO + H2O(г) +182,8 кДж. Определите стандартную теплоту образования оксида свинца (PbO).
69. Вычислите стандартную теплоту образования бензойной кислоты С6Н5СООН(крист.), если стандартная теплота сгорания бензойной кислоты составляет –3227,54 кДж/моль.
70. Вычислите тепловой эффект реакции образования сульфата алюминия по реакции: Al2O3(к) + 3SO3(г) = Al2(SO4)3(к), если известны стандартные теплоты образования реагирующих веществ. Используйте справочные данные в приложении.
71. Зная стандартные теплоты сгорания этана, метана и водорода, определите ∆Н0298 реакции образования метана: С2Н6(г) + H2(г) = 2СН4(г). Используйте справочные данные в приложении.
72. По стандартным теплотам сгорания веществ рассчитайте ∆Н0298 реакции образования этилацетата из этанола и уксусной кислоты:
С2Н5ОН(ж) + СН3СООН (ж) = СН3СООС2Н5(ж) + Н2О,
∆Н0сгор. (СН3СООС2Н5) = –2254,21 кДж/моль.
Конечные продукты сгорания – газообразный СО2 и жидкая Н2О. Используйте справочные данные в приложении.
73. Определите тепловой эффект реакции образования гидроксида натрия и водорода: NaH(к) + Н2О(ж) = NaОН(р) + Н2(г) по стандартным теплотам образования веществ, участвующих в реакции, если ∆Н0NaH (к) = –56,94 кДж/моль, ∆НоNaОН (р) = –469,47 кДж/моль.
74. Определите тепловой эффект реакции образования оксида свинца из сульфида свинца: 2PbS + 3O2 = 2PbO + 2SO2, используя табличные значения стандартных теплот образования реагирующих веществ.
75. Найдите стандартную энтальпию реакции синтеза оксида азота (IV): 2NO + О2 = 2NO2, если ΔH0(NО2) = –33,69 кДж/моль, ΔH0(О2) = 0, ΔН0(NО) = 90,37 кДж/моль.
76. Рассчитайте калорийность сахарозы, то есть стандартную молярную теплоту ее сгорания по уравнению: С12Н22О11 + 12О2 = 12СО2 + 11Н2О, если ΔН0(С12Н22О11) = –4824,0 кДж/моль, ΔH0(О2) = 0, ΔH0(СО2) = –393,51 кДж/моль, ΔH0(Н2О) = –241,82 кДж/моль. Полученное значение выразите в калориях на 1 г вещества.
77. Найдите стандартную энтальпию реакции образования оксида серы (VI) из оксида серы (IV): 2SO2 + О2 = 2SO3, если ΔH0(SO3) = –395,2 кДж/моль, ΔН0(SO2) = –296,9кДж/моль, ΔfH0(О2) = 0.
78. Найдите стандартную энтальпию реакции окисления сероводорода: 2Н2S + О2 = 2SO2 + 2Н2О, если ΔH0(Н2О) = –241,82 кДж/моль, ΔН0(SO2) = –296,90 кДж/моль, ΔH0(Н2S) = –20,15 кДж/моль, ΔfН0(О2) = 0.
79. Найдите стандартную энтальпию реакции сгорания ацетилена: 2С2Н2 + 5О2 = 2Н2О + 4СО2, если ΔH0(H2О) = –241,82 кДж/моль, ΔH0(СО2) = –393,51 кДж/моль, ΔH0(С2Н2) = 226,75 кДж/моль, ΔfH0(О2) = 0.
80. Найдите стандартную энтальпию реакции сгорания метана: СН4 + 2О2 = СО2 + 2Н2О, если ΔH0(H2О) = –241,82 кДж/моль, ΔH0(СО2) = –393,51 кДж/моль, ΔH0(СН4) = –74,85 кДж/моль, ΔН0(О2) = 0.
81. Найдите стандартную энтальпию реакции горения метанола: СН3ОН + 3О2 = 2СО2 + 4Н2О, если ΔН0(СО2) = –393,51 кДж/моль, ΔH0(СНзОН) = –288,70 кДж/моль, ΔН0(Н2О) = –241,82 кДж/моль.
82. Найдите стандартную энтальпию реакции горения этановой кислоты: СН3СООН + 2О2 = 2CO2 + Н2О, если ΔН0(Н2О) = –241,82 кДж/моль, ΔH0(CO2) = –393,51 кДж/моль, ΔН0(СН3СООН) = –484,90 кДж/моль.
83. Найдите стандартную энтальпию реакции образования гидроксида кальция: СаО + Н2О = Са(ОН)2, если ΔH0(Са(ОН)2) = –986,20 кДж/моль, ΔH0(H2O) = –241,82 кДж/моль, ΔH0(CaO) = –635,50 кДж/моль.
84. Найдите стандартную энтальпию реакции: СО + Сl2 = СОСl2, если ΔH0(COCl2) = –482,00 кДж/моль, ΔН0(СО) = –110,53 кДж/моль.
85. Найдите изменение энтропии при стандартных условиях для реакции: 2NO + О2 = 2NO2, если S0(NO2) = 240,45 Дж/(моль.К); S0(О2) = 205,18 Дж/(моль.К); S0(NO) = 210,62 Дж/(моль.
...