автордың кітабын онлайн тегін оқу Основные тенденции и перспективы развития дактилоскопии в США. Монография
А. Г. Холевчук
Основные тенденции и перспективы развития дактилоскопии в США
Монография
Информация о книге
УДК 343.98(73)(075.8)
ББК 67.52(7Сое)я73
Х71
Изображение на обложке James Steidl / Shutterstock.com
Автор:
Холевчук А. Г., кандидат юридических наук, преподаватель кафедры уголовного процесса и криминалистики Новороссийского филиала Краснодарского университета МВД России.
Рецензенты:
Кручинина Н. В., доктор юридических наук, профессор, профессор кафедры криминалистики Московского государственного юридического университета имени О. Е. Кутафина (МГЮА);
Лебедева А. А., кандидат юридических наук, доцент кафедры криминалистики Московской академии Следственного комитета Российской Федерации, подполковник юстиции;
Данильян А. С., кандидат юридических наук, доцент, начальник кафедры уголовного процесса Краснодарского университета МВД России, подполковник полиции.
В работе рассмотрены перспективные направления развития дактилоскопии в США. Раскрыты физико-химические методы визуализации следов пальцев рук, методы ДНК-анализа потожирового вещества. Проанализированы проблемы повышения качества получения соответствующих образцов в целях идентификации личности; применяемые в процессе дактилоскопических исследований информационные системы и технологии; статистические модели оценки обоснованности экспертных выводов в судебно-дактилоскопической экспертизе; основные направления установления давности отображения следов пальцев рук и формирование новых теоретических концепций образования папиллярных гребней.
Монография адресована специалистам в области судебной дактилоскопии и судебно-дактилоскопической экспертизы – научным сотрудникам, педагогическим работникам профильных вузов. Материалы работы могут использоваться в образовательном процессе при подготовке курсантов и слушателей, студентов юридических вузов, будут интересны сотрудникам органов предварительного расследования, оперативным работникам органов внутренних дел и всем интересующимся проблемами дактилоскопии.
УДК 343.98(73)(075.8)
ББК 67.52(7Сое)я73
© Холевчук А. Г., 2021
© ООО «Проспект», 2021
ВВЕДЕНИЕ
Ничто не вечно под луной. Но жизнь
Бессмертна эстафетой поколений.
Коль этим даром, друг мой, дорожишь,
Оставь свой след, отбросив яд сомнений.
У. Шекспир
В настоящее время в криминалистической и судебно-экспертной науках повышенное внимание уделяется вопросам конвергенции отдельных положений зарубежного опыта в следственно-судебную и экспертную практику. Критики имплементации зарубежного опыта справедливо полагают, что его использование в решении частных криминалистических и судебно-экспертных задач ведет к появлению проблем в правоприменительной деятельности и формированию не характерного для отечественной следственно-экспертной практики опыта. Сторонники конвергенционных процессов и изменений отечественной криминалистической науки правы в том, что изменения, основанные на глубоком изучении передового опыта зарубежных государств, необходимы. Во всяком случае, у сторонников и противников идей внедрения зарубежного опыта общее видение решения обозначенных проблем в рамках наук криминалистики и судебной экспертизы.
Предметом настоящего исследования является анализ опыта США в области дактилоскопии. Несмотря на фундаментальную теоретическую основу данного раздела в отечественной и зарубежной криминалистике, судебной экспертизе, иностранными исследователями систематически проводятся исследования по повышению эффективности методов, средств и технологий, используемых в дактилоскопии.
Анализ научной литературы, вышедшей в США в начале XXI века, свидетельствует о применении новых подходов и методов в дактилоскопических исследованиях, пересмотре отдельных традиционных вопросов и проблем, связанных с оценкой заключений экспертов-дактилоскопистов, поиске перспективных методов анализа потожирового вещества в целях идентификации личности посредством ДНК. Несмотря на экспериментальный характер рассматриваемых методов, многие из них показали практическую эффективность, другие, в силу различных обстоятельств, признаны нецелесообразными для использования в судебно-экспертной и криминалистической деятельности. Обращается внимание на финансовую составляющую некоторых методов, их относительно высокую стоимость. В целом ряде случаев установлено, что методы, требующие значительных затрат, могут быть заменены альтернативными, не менее эффективными и наименее затратными.
Значимость исследования заключается в том, что данная работа основывается на системном анализе научной литературы в области дактилоскопии, вышедшей в США в начале XXI века. В работе содержатся данные о наиболее актуальных и современных средствах и методах, используемых для проведения экспертных исследований, имеющих различную целевую направленность.
Цель исследования состоит в определении основных направлений развития дактилоскопии в США, поиске оптимальных средств визуализации следов пальцев рук, развитии новых подходов в оценке заключений экспертов-дактилоскопистов, внедрении новейших информационных технологий в следственную и экспертную практику. Для реализации обозначенных целей рассмотрены основные (традиционные) дактилоскопические методы и средства, используемые в экспертной практике правоохранительных подразделений США. Кроме того, уделено внимание перспективным методам и средствам, еще не нашедшим своего применения в экспертной практике правоохранительных органов США.
Неоценимую помощь в написании работы автору оказали студенты Кубанского государственного университета филиала в г. Новороссийске, участвовавшие в выполнении определенной части переводов исследований на указанную тематику. Автор выражает глубокую признательность выпускникам юридического факультета О. С. Поповой, А. В. Уварову, О. А. Городничей за стремление к изучению опыта США в области дактилоскопии и их благородный труд. Кроме того, автор выражает особую признательность своему руководителю и Другу — заведующей кафедрой гуманитарных дисциплин Новороссийского филиала Кубанского государственного университета, кандидату юридических наук, доценту — Грузинской Екатерине Игоревне за поддержку и помощь в аспекте организованной автором работы по изучению зарубежного опыта. Хочу также поблагодарить свою супругу — Холевчук Юлию Александровну за терпимое отношение к творческим мытарствам автора и систематические, длительные редакционно-технические правки текста работы.
Глава 1. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СЛЕДОВ ПАЛЬЦЕВ РУК
§ 1.1. Адаптация флуоресцентных красителей для оптимизации процесса визуализации следов пальцев рук
На протяжении последних 30 лет физический проявитель1 (далее — ФП) остается основным средством визуализации невидимых следов пальцев рук, отображенных на пористых поверхностях. В ряде случаев он имеет ограничения, а его применение на пористых поверхностях, подвергшихся воздействию влаги, осложняется тем, что чувствительные к аминокислотам реагенты не эффективны2. Модификации ФП изучались различными исследователями в попытке стабилизировать окислительно-восстановительный раствор и получить оптимальный контраст отпечатка3. В зарубежной литературе применение ФП описывается как сложный, трудоемкий и дорогостоящий способ4, требующий создания лабораторных условий.
В процессе использования ФП введение загрязнений или вмешивающихся ионов может влечь сокращение соотношения серебряных ионов к элементному серебру или формированию серебряной окиси5, что в итоге приводит к окрашиванию фона и потере контрастности между обнаруженными деталями отпечатка и поверхностью, на которой они отображены. Выпадение в осадок серебра в окислительно-восстановительном растворе негативно воздействует на реагент, снижая концентрацию его ионов. Дополнительное очищение с помощью малеиновой кислоты для удаления щелочных компонентов бумаги способствует обнаружению отпечатков с помощью ФП. Частичное растворение щелочного связующего вещества на поверхности газетной бумаги приводит к тому, что исследуемый объект истончается и с ним становится сложно работать6. Несмотря на указанные проблемы, ФП остается надежным средством обнаружения невидимых отпечатков на пористых поверхностях, подвергшихся воздействию влаги7. Его используют на пористых сухих поверхностях в заключительной стадии процесса обнаружения отпечатков, что способствует их выявлению с помощью реагентов чувствительных к аминокислоте8.
Гистологические красители, применяемые для выявления потожировых веществ, необходимы при исследовании органических красителей, являющихся альтернативой ФП. Краситель Oil Red O (ORO) применяется для улучшения качества визуализации отпечатков посредством выявления компонентов жирового вещества9. Хотя исследование Oil Red O имело прогрессивный характер, дополнительные исследования показали, что краситель наиболее эффективен при визуализации невидимых свежих следов пальцев рук. Применение ФП ограничивается при необходимости исследования возрастных отпечатков. Предполагается, что краситель Oil Red O предназначается для изменчивых компонентов сальных желез, а ФП ориентирован на изучение стабильных выделений. Кроме того, визуализация ограничивается видимым поглощением, означающим, что, как и с ФП, получить необходимый контраст отпечатка на темных основаниях затруднительно10. Следовательно, изучение люминесцентных альтернатив ФП должно основываться на рассмотрении люминесцентных красителей, взаимодействующих с множеством компонентов жирового вещества.
Красный Нил (далее — КН) первоначально использован Дж. Сандерсом (G. Saunders) в качестве альтернативы ФП11. Ранее краситель применялся для визуализации фосфолипидов, холестерина, сложных эфиров холестерина и триацилглицерола в исследуемых образцах ткани животных12. Указанные составляющие включают значительную часть липидных фракций выделений отпечатка13.
Люминесцентные свойства КН изменяются в зависимости от используемой системы (комплекса) растворителей с полярными апротонными растворителями (в частности, ацетоном), производящими широкое красное смещение свечения по сравнению с неполярными растворителями14. Протоносодержащие растворители, в частности вода, приводят к подавлению люминесценции. Объедение этих свойств с химическим составом бумажных оснований (объектов) влечет детализацию люминесцентного края отпечатка с выборочным смещением нелюминесцентного красителя КН на бумажном фоне, эффективно подавляющего воздействие заднего фона.
Предварительные исследования КН, используемого для улучшения визуализации отпечатков на пористых поверхностях, погружаемых в воду, показали положительные результаты с применением состава реагентов, предложенных Дж. Сандерсом (G. Saunders) (1 мг красителя «Красный Нил» в 1 мл ацетона или диметилсульфоксида (DMSO), подготовленного для 1 л воды). Названные реагенты способствовали обнаружению отпечатков для получения результата, улучшающего применение ФП в процессе исследования отпечатков возрастом до двух месяцев, отображенных на белой копировальной бумаге15. Результаты предварительного исследования оказались перспективными, а флюоресценция (свечение) фона определена исследователями, как проблема механизма исследования следовоспринимающих объектов, содержащих большой объем рекуперированных бумажных волокон. Важным является тот факт, что попытки включить КН в типичную последовательность процесса обнаружения отпечатков на сухих пористых поверхностях, привели к образованию размытых краев отпечатка. Кроме того, Дж.Ф. Дэуе (J. F. Deye) установил быстрое фотоотбеливание отпечатков, обнаруженных с помощью КН16.
Анализируемое исследование акцентировалось на улучшении раствора за счет включения в его состав красителя КН для оптимизации процесса использования аминокислотных реагентов, снижения уровня сложности и времени рассмотрения, требуемого для повышения четкости изображения отпечатка. Экспериментально требовалось оценить работу оптимизированного раствора с КН, сравнив соответствующие качества с ФП на большой группе исследуемых видов поверхности с новыми образцами отпечатков и образцами возрастом до пяти лет.
В экспериментах использовались следующие материалы: лимонная кислота, малеиновая кислота, растворители (AR grade), хлорид цинка и нитрат серебра, полученные из BDH-Prolabo (VWR International Pty. Ltd., Австралия). Краситель КН (BioReagent, Sigma–Aldrich, США), гидроокись натрия (MerckChemicals, Австралия), 1,2-индандион (Casali Institute, Израиль), 1,8-диазафлуорен-9-он (BVDA, Нидерланды), ледяная уксусная кислота (ChemSupply, Австралия), нитрат железа девятиводный (Sigma–Aldrich, США), сурфактант Teric X10 (ICI Australia Operations Pty. Ltd.) и ацетат N-додециламин (Optimum Technologies, Австралия).
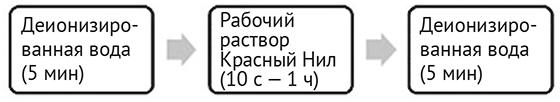
Рис. 1. Технологический процесс обработки/рассмотрения пористых поверхностей с помощью красителя Красный Нил17
Для подготовки раствора КН (0.10 г, 0.31 ммоли) добавлялся к AR grade метанолу (1.00 L) и размешивался до полного растворения. Раствор (0.01%) гидроокиси натрия (0.10 г, 2.50 ммоли) подготавливался в деионизированной воде (1.00 л). Раствор подготавливался при постепенном добавлении исходного раствора (200 мл) к равному объему 0.01% (w/v — вес/объем) раствора гидроокиси натрия (приблизительно pH 12). Далее преобразованный раствор подготавливался посредством постепенного добавления 230 мл исходного раствора к 170 мл 0.01% (w/v) раствора гидроокиси натрия.
Исследуемые образцы помещались в деионизированную водную ванну на 5 минут до появления деталей отпечатка, затем смешивались для удаления неровностей на поверхности бумаги. После чего образец быстро высушивался и помещался в раствор КН, аккуратно перемешивался до визуализации отпечатков по истечении 1 часа (рис. 1). Перед высыханием образцы обрабатывались в деионизированной водной ванне в течение 5 минут и проявлялись с помощью источника экспертного света Polilight PL500 и системы ввода и улучшения изображения Rofin Poliview IV (возбуждение 490 нм с 555 нм с полосовым барьерным фильтром).
Рабочий раствор нингидрина (с растворителем носителя петролейного эфира, раздел 2.5) и растворы для ФП подготовлены по методу К. Чампод (C. Champod)18. Рабочие растворы нингидрина и индандиона с растворителем носителя HFE 7100 подготовлены по аналогии с процедурой, указанной в табл. 1. Образцы, рассматриваемые с помощью нингидрина или индандиона-цинка, погружались в реагент, затем высушивались на воздухе в течение 2 минут. После нагревались горячим прессом (Singer Magic Steam Press 7) в течение 10 секунд при 165 градусах по Цельсию. Обработанные с помощью нингидрина объекты на короткое время подставлялись под струю пара перед помещением в темный шкаф для хранения и мониторинга температурной реакции при 22 градусах по Цельсию, 55%-ной влажности в течение 24 часов. Затем образцы визуализировались при оптимальном возбуждении и соответствующей длиной волны барьерного фильтра (табл. 2) с использованием Rofin Poliview IV и Polilight PL500.
Процедура сбора отпечатков носила последовательный характер: образцы отбирались у трех мужчин и трех женщин. Наиболее четкие и приведенные в необходимый вид отпечатки собирались после инструктажа доноров о необходимости потереть пальцами поверхность лба и носа перед перенесением отпечатка на следовоспринимающий объект. Дополнительно донорам сообщали о необходимости избегания касаний поверхности лица в течение 10 минут до взятия отпечатков. Отобранные образцы высушивались на воздухе, после чего помещались в бумажные конверты для сохранения.
Объекты и параметры их исследования отбирались с учетом определенной типичности дел, в которых изучению подвергались отпечатки со слабовыраженным контрастом при их обработке ФП. Нетронутое волокно (Reflex UltraWhite) и 100% переработанные (Evolve Every day) белая копировальная бумага, коричневая Крафт-бумага (67 GSM), пролинованная блокнотная бумага, газетная бумага, глянцевая журнальная бумага и черный картон, использовались в качестве экспериментальных образцов. Полученные отпечатки трех пальцев сохранялись на определенный период (1 неделя, 1 месяц, 2 месяца, 3 месяца). Один набор содержался в темном помещении, другой — в естественно освещенном закрытом помещении. Новые отпечатки (менее 24 ч) взяты и законсервированы на ночь перед их обработкой. Естественное уменьшение ряда отпечатков трех пальцев, состоящих из четырех отпечатков, собраны и выявлены после 24 часов и 3 месяцев. В течение часа образцы пропитывались деионизированной водой и за ночь высушивались до обработки КН и ФП. Отпечатки неизвестных доноров, собранные на белой копировальной бумаге, коричневом бумажном мешке и желтых конвертах Крафт, состаренные в течение 2 лет в темноте, также изучались.
Сравнительная шкала, предложенная К. Маклареном (C. McLaren)19, сформирована для оценки функциональности красителя по отношению к ФП в отпечатках, собранных в разных условиях. Образцы получили оценку между -2 и +2 в зависимости от качества одной части объекта, рассматриваемой с помощью КН относительно другой части, исследованной с помощью ФП. Оценки получены с учетом выявления деталей отпечатка и контрастности фона в каждой половине исследуемого объекта.
Таблица 1
Составы для рабочих составов нингидрина и индандиона-цинка HFE (подготовленные приблизительно к 1 л)
| Реа- гент (г) |
Этанол (мл) | Этила- цетат (мл) |
Уксу- сная кис- лота (мл) |
HFE 7100 (мл) | 4% (w/v) спиртовый ZnCl2 (мл) | |
| Нингидрин | 4,55 | 55,3 | 4,55 | 5,20 | 935 | – |
| Индандион | 0,60 | – | 90 | 10,0 | 900 | 4,00 |
Таблица 2
Параметры визуализации, используемые для нингидрина, индандиона-цинка и обнаруженных с помощью ФП отпечатков
| Нингидрин | Индандион-цинк | ФП | |
| Иллюминация (нм) | Белый свет | 505 | Белый свет |
| Фильтр (нм) | 555 | 555 | Нет фильтра |
Таблица 3
Средняя сравнительная оценка отпечатков пальцев, основанная на использовании красителя КН, к ФП с учетом определенного временного периода
| Возраст отпечатков (дни) | Естественные отпечатки | Заполненные отпечатки | ||
| Состаренные | В темноте | При свете | В темноте | При свете |
| 0 | –0,8 | –0,8 | 1,6 | 1,8 |
| 7 | –0,4 | –0,4 | 1,2 | 0,8 |
| 28 | –0,8 | –0,8 | 0,4 | 0,8 |
| 56 | –1,2 | –0,8 | 0,9 | 0,8 |
| 4 | –1,0 | –0,8 | 0,4 | 1,2 |
| 183 | –0,5 | – | – | – |
| 730 | –0,4 | – | – | – |
Расхождение в показателях отпечатков было равно или больше средней оценки для различного возраста отпечатков (кроме образцов 56-дневной давности), демонстрирующих достаточное разнообразие доноров.
Качество изображения отпечатков, обнаруженных с помощью КН и ФП, оценивалось для определения эффективности с помощью шкалы Х. Л. Банди (H. L. Bandey)20.
Отображенные в естественных условиях на копировальной бумаге UltraWhite Reflex и состаренные в темном шкафу отпечатки были получены у пяти доноров. Отпечатки, содержащие сальный материал, собраны в качестве контрольных образцов. До систематизации исследования, карбонатный буфер (pH 7.0, 9.0 и 10.0) и 2.5% (в/о) раствор малеиновой кислоты помещались в водную ванну в целях исключения вмешательства ионов или возникновения реакции до обнаружения с помощью КН.
В сравнительных целях все объекты разделялись на две части и выявлялись в соответствии с последовательностью изучения разных поверхностей, представленных на рис. 2. Одна половина отпечатка проявлялась с помощью КН, включенного в последовательность до использования ФП, другая — с помощью красителя, примененного после ФП. Результаты каждой последовательности оценивались с помощью сравнительной шкалы К. Макларена (C. McLaren)21. Оба (HFE 7100 носитель) раствора, содержащих нингидрин и петролейный эфир, последовательно оценивались для определения негативного влияния распада короткой цепи или изменчивых сальных компонентов на функциональность красителя.
Исследуемые образцы собирались со страниц, отобранных из 23 экзаменационных буклетов, сохраненных и не используемых в помещении с контролируемыми климатическими условиями (в среднем 22 градуса по Цельсию, 55%-ный RH) в течение пяти лет. Информация о доноре скрывалась в целях обеспечения анонимности. Средний возраст группы варьировался в диапазоне 18–22 года. Объекты передавались кандидатам для сдачи экзаменов до их сохранения. После чего две исписанные страницы извлекались из каждого буклета и рассматривались с применением дактилоскопических средств в следующей последовательности.
1. Красный Нил применялся после ФП.
2. ФП применялся после Красного Нила.
Отпечатки, обнаруженные по первому методу, подсчитывались и фотографировались перед применением второго реагента в последовательности.
Функциональность КН и ФП исследована на достаточном количестве образцов. Сравнение результатов рассмотрения отпечатков с помощью КН с данными, полученными в результате применения ФП на белой копировальной бумаге, показало, что краситель проявлял слабые и неполные детали узора отпечатка (табл. 3). Исследование новых отпечатков, защищенных от света, показало позитивные результаты обнаружения с использованием красителя с устойчивым снижением качества изображения отпечатка в сравнении с ФП по мере его состаривания. Быстрое преобразование триглицеридов в жирные кислоты с помощью липазы, окисление ненасыщенных липидов и окислительный метаболизм жирных кислот для формирования в цепи кетонов и другие побочные продукты точно определены как биохимические процессы, образованные в целях разложения сальных материалов, взятых с поверхности кожи. Эксперименты проведены в пробирке с чистыми жирными кислотами22. Такое уменьшение не наблюдалось в образцах, подвергнутых комплексу флуоресцентного освещения и солнечного света. Прогнозировалось снижение потерь целевых компонентов из-за выставления на свет. Возможно, посредством служащей промежуточным этапом УФ денатурацией ферменты липазы и гибель бактерий на поверхности кожи преобразовалась во время отображения отпечатка.
Приведенные в надлежащий вид контрольные группы показали оптимальный результат при использовании КН с наблюдаемым уменьшением функциональности красителя для образцов, состаренных в темноте. Р. С. Крокстон (R. S. Croxton) отметил, что процедура, приведения в надлежащий вид, используемая для подготовки отпечатков с большим объемом потожирового вещества, существенно увеличивает количество C12 до C18 жирных кислот наряду с другим содержанием липида23. Предшествующее исследование активности липазы, с точки зрения дерматологической перспективы C12 к триглицеридам C18 показало гидролизацию комплекса человеческих и бактериальных липаз для формирования смеси свободных жирных кислот (доминирующий продукт), моно- и диглицерид в пределах 7–10 дней24. Эти процессы оставляют неизменными сложный эфир воска и длинную цепь липидных компонентов отпечатка, приводя к лучшему результату применения ФП25. Предполагается, что нестабильная фракция триглицерида указывает на близкое сходство с КН, при этом сложный эфир воска и холестериновые фракции могут обнаруживаться с подвергнутой риску чувствительностью. Взаимосвязь между наблюдениями и уровнем триглицеридных жирных кислот в отпечатке в настоящее время исследуется.
Анализ исследуемых объектов показал взаимосвязь между свойствами бумажного материала и качеством визуализации отпечатков. КН эффективнее использовался на каландрированных основаниях, таких как копировальная бумага, содержащая длинные плотно упакованные волокна целлюлозы и высококачественные наполнители карбоната кальция. Газетная и крафт-бумага, состоящая из низкокачественного переработанного механического материала, характерна низкой плотностью волокна целлюлозы в отличие от копировальной бумаги, проявляющей неполные отпечатки при их обнаружении с помощью КН.
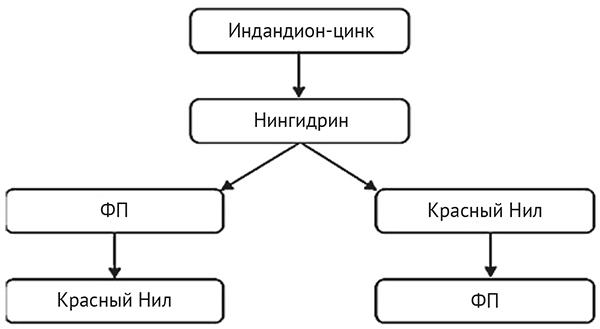
Рис. 2. Схема процесса последовательного использования КН с Ind-Zn и нингидрином26
Обнаруженные с помощью ФП отпечатки характеризовались определенной последовательностью выявления, четкостью элементов края на исследуемых объектах (табл. 4). Это могло возникнуть из-за различной распространенности целевых (которые следует обнаружить) сальных выделений для каждого реагента, с фракцией сложного эфира воска, являвшейся целью ФП27.
Таблица 4
Качество обнаруженного с помощью КН материала в сравнении с ФП для отпечатков возрастом 1 месяц, смоченных перед обнаружением
| Основание | Естественные следы |
| 0% переработанная белая копировальная бумага | 0.3 |
| 100% переработанная белая копировальная бумага | –0.9 |
| Блокнотная бумага | –0.7 |
| Коричневая бумага крафт | –0.6 |
| Газета | –0.3 |
| Глянцевая журнальная бумага | –0.6 |
| Черный картон | 0.0 |
Расхождение в количестве отпечатков было похожим или большим, чем средние показатели каждого вида исследуемых оснований.
Черный картон выбран исследователями из-за его характеристик, поскольку это сложная поверхность для ФП, создающая ограниченную контрастность на черном фоне. Прогнозировалось, что КН может обеспечить улучшенную контрастность с учетом его люминесцентных свойств. Однако люминесценция, наблюдаемая в обнаруженных отпечатках, оказалась недостаточной для создания высококонтрастных элементов отпечатка (с черным основанием, подавляющим эмиссию красителя). В результате не было обнаружено существенных отличий между отпечатками, визуализированными с помощью КН и ФП.
Преобразование раствора КН для обработки отпечатков возрастом несколько лет. В период обработки страниц экзаменационного буклета установлено, что краситель эффективен только при исследовании одной-двух страниц. Время обнаружения увеличивается пропорционально числу исследуемых страниц. Раствор изменен в целях создания большего объема красителя (230 мл) к гидроокиси натрия (170 мл), испытан с использованием четырех рядов отпечатков, разделенных на две части, отобранных у одного донора в течение дня. При использовании преобразованного раствора достигнут оптимальный результат с состаренными и разделенными пополам отпечатками по сравнению с первоначальным раствором (рис. 3). Учитывая, что возраст действующих образцов был неизвестен, а тестирование включало обработку большого количества доказательств, исследователями сделаны выводы, что установленные в экспериментах преимущества КН достаточны для его использования в экспертной деятельности.
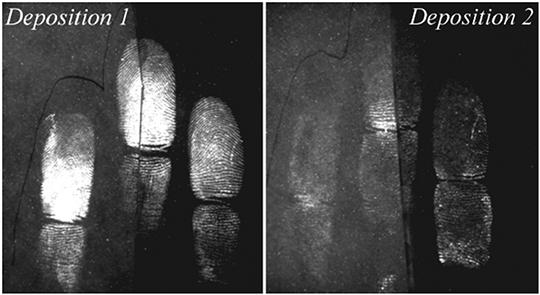
Рис. 3. Сравнение исходного рабочего раствора КН (левая половина) с преобразованным раствором (правая половина)
В общих чертах, для преобразованного раствора была доказана контрастность гребней отпечатков и улучшенная однородность осадка, особенно для слабых отпечатков28.
Растворимость КН значительно улучшилась в преобразованном растворе в связи с увеличением объема метанола в соотношении с объемом воды. Отмечалось, что краситель выпадает в осадок при испарении метанола. В несинтезированном растворе процесс шел медленнее. Добавление небольшого количества метанола и его помешивание было достаточно для повторного растворения и увеличения срока хранения раствора, влияющего на концентрацию красителя.
Изначально работа по анализу липидных пятен на целлюлозном листе и пористой бумаге для фильтрования с помощью тонкослойной хроматографии предполагала, что краситель имеет продолжительность свечения около 4 часов при его нанесении на целлюлозный объект. Подобные наблюдения сделаны в процессе рассмотрения образцов, хранящихся около 24 часов до визуализации. Визуализация 4 рядов отпечатков, разделенных на две части, исследованных в целях сравнения рабочего раствора длительностью 24 часа — 1 неделя показала, что отпечатки, обнаруженные с помощью красителя, лучше рассматривать в течение часа обработки. Сильное свечение и четкие детали различимы в отпечатках, содержащих большое количество липидов после 24 часов, люминесценция становилась ограниченной после 1 недели хранения (рис. 4). Следовательно, отпечатки, обнаруженные с помощью красителя, рекомендуется визуализировать и фотографировать в течение 1 часа с момента обнаружения.
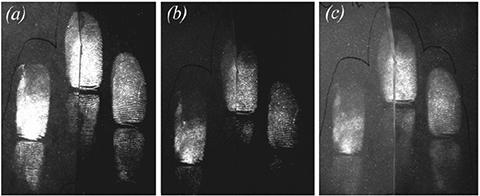
Рис. 4. Уменьшение свечения КН после: 1 часа (а), 24 часов (b), после недели хранения (c)29
Красный Нил мог быть включен в последовательность проявления с Ind-Zn и основанный на HFE нингидрин на естественных отпечатках с качественными деталями и полученным контрастом (рис. 5). В нескольких случаях две части отпечатков, обнаруженные с помощью красителя, демонстрировали высокую четкость в отличие от половины, исследуемой с помощью ФП. Это указало, что липофильные растворители готовили аминокислотный реагент, растворы не оказывали негативного влияния на фракцию, которая должна выявляться с помощью красителя. Однако составы нингидрина, использующие растворитель петролейного эфира, могут инициировать распространение или ликвидацию некоторых компонентов в рамках неустойчивой части липида. Влияние составов нингидрина, основанных на петролейном эфире, на обнаружение с помощью красителя требует проведения дополнительных исследований, поскольку в процессе экспериментов получены противоречивые результаты.
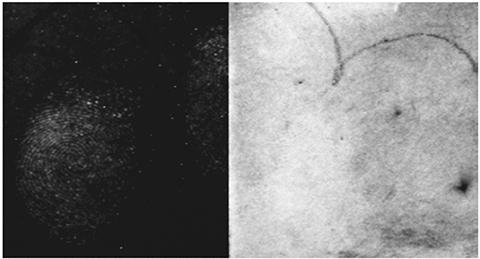
Рис. 5. Трехмесячные естественные отпечатки на переработанной белой копировальной бумаге с Reflix 0%, разработанные сначала с Ind-Zn, затем с нингидрином и, наконец, с применением КН (слева) и ФП (справа). КН был сфотографирован при 490 нм стимуляции и 555 нм фильтром полосового барьера. ФП фотографировался под белым светом30
Сравнение отпечатков, обнаруженных с помощью аминокислотных реагентов, сопровождаемых КН в последовательности до и после применения ФП позволило установить, что краситель эффективнее использовался на заключительном этапе. Значительный осадок нерастворимых серебряных частиц наблюдался на исследуемом фоне, тогда как краситель применяли к объектам до ФП, что влекло низкую контрастность и нечеткие детали папиллярного узора. Присутствие отдельных видов ионов, участвующих в окислительно-восстановительных реакциях, дало выпадение осадка серебряной окиси и других нерастворимых серебряных солей во время обнаружения отпечатка с помощью ФП31.
В некоторых случаях визуализация отпечатков и проявление деталей узора с помощью ФП улучшилась посредством рассмотрения объектов с помощью красителя в заключительной стадии использования (рис. 6). В результате наблюдений лабораториям, использующим краситель в целях проявления отпечатков, рекомендовано применять его в заключительной части процесса визуализации (рис. 7).

Рис. 6. Свежие заряженные отпечатки на переработанной белой копировальной бумаге с Reflix 0% обработанные сначала ФП (слева), затем КН (Naile red) после дионизированной водой (справа). КН сфотографирован при 490 нм стимуляции и 555 нм фильтром полосового барьера. ФП фотографировался под белым светом32
Сравнение отпечатков, обнаруженных на 23 страницах экзаменационных буклетах с помощью красителя и ФП, показало, что ФП способствовал обнаружению отпечатков в три раза чаще, чем Красный Нил (табл. 5). В нескольких случаях установлена взаимосвязь между донорами, отпечатки которых слабо взаимодействуют с Красным Нилом, что приводит к негативным последствиям при использовании ФП в сравнении с другими образцами (например, вещественное доказательство 2).
Оценка двух последовательностей применения дактилоскопических средств показала, что использование Красного Нила после ФП оказалось эффективным для сбора максимального количества отпечатков с большим количеством обнаруженных в среднем на 50% в соотношении с обратной последовательностью (табл. 5). При использовании ФП после красителя ставилась под угрозу стабильность окислительно-восстановительного раствора с меньшим количеством страниц, которые возможно обнаружить и большей предрасположенностью к вторичному обнаружению на указанном фоне. Вероятно, причиной этого является нерастворимость осадка красителя в воде и малеиновой кислоте, влекущая задержку органических и ионных веществ, препятствующих оседанию серебра на исследуемом фоне.
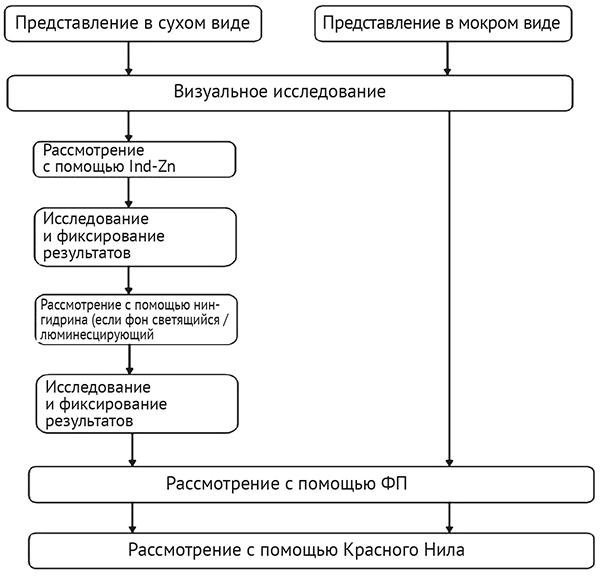
Рис. 7. Последовательности, используемые для улучшения изображения невидимых отпечатков на пористых поверхностях33
В дополнение к полученным результатам установлено, что отпечатки, обнаруженные с помощью ФП, не показали качественного улучшения изображения с помощью красителя. Полагаем, что краситель предназначался для отпечатков, оставшихся необнаруженными с помощью ФП. Исследование ориентировалось на определение эффективности методов, используемых для различных компонентов состава потожирового вещества (использование нескольких рядов разделенных отпечатков). Определено, что КН превосходил ФП при первоначальном разделении на половины естественных и заполненных рядов отпечатков, но показал снижение чувствительности для оставшихся трех отпечатков в группе с разделенными отпечатками. Подтверждена гипотеза, что КН предназначается для компонентов состава потожирового вещества экзокринной гидролипидной пленки и разложения продуктов сальных остатков, таких как холестерин и свободные жирные кислоты с большей чувствительностью, чем длинные сложные эфиры воска, полученные из сальных желез, существующих в большей концентрации. Следовательно, существует постоянство в ряде разделенных на половины отпечатков34.
Таблица 5
Количество отпечатков, обнаруженных с помощью красителя КН (Nail red) после ФП (последовательность 1) и ФП, а затем КН (последовательность 2)
| Номер вещест- венного доказа- тельства |
Наблюдаемые отпечатки (последовательность 1) |
Наблюдаемые отпечатки (последовательность 2) |
||||
| Красный Нил | ФП | Всего | ФП | Красный Нил | Всего | |
| 1 | 12 | 14 | 26 | 37 | 22 | 59 |
| 2 | 3 | 9 | 12 | 5 | 17 | 22 |
| 3 | 8 | 0 | 8 | 8 | 22 | 30 |
| 4 | 12 | 2 | 14 | 37 | 10 | 45 |
| 5 | 20 | 7 | 27 | 50 | 15 | 65 |
| 6 | 27 | 8 | 35 | >60 | 19 | >79 |
| 7 | 15 | 10 | 25 | 42 | 24 | 66 |
| 8 | 17 | 2 | 19 | 27 | 20 | 47 |
| 9 | 24 | 2 | 26 | 10 | 18 | 28 |
| 10 | 16 | 3 | 19 | 6 | 28 | 34 |
| 11 | 23 | 20 | 43 | 2 | 14 | 16 |
| 12 | 30 | 24 | 54 | 21 | 18 | 29 |
| 13 | 21 | 15 | 36 | 20 | 17 | 37 |
| 14 | 5 | 7 | 12 | 6 | 23 | 29 |
| 15 | 13 | 4 | 17 | 6 | 17 | 23 |
| 16 | 7 | 10 | 17 | 9 | 14 | 23 |
| 17 | 11 | 4 | 15 | 11 | 21 | 32 |
| 18 | 11 | 5 | 12 | 26 | 19 | 28 |
| 19 | 7 | 0 | 7 | >60 | 19 | >79 |
| 20 | 28 | 52 | 80 | 8 | 20 | 28 |
| 21 | 2 | 16 | 18 | 1 | 3 | 4 |
| 22 | 20 | 24 | 44 | 8 | 4 | 12 |
| 23 | 15 | 25 | 40 | >60 | 14 | >74 |
| Среднее | 26 | 39 | ||||
Отметим, что щелочной состав красителя, детализированный в работе, способствует обнаружению невидимых отпечатков на различных бумажных основаниях, подвергшихся воздействию влаги. Краситель позволяет выполнить детализацию отпечатков возрастом до пяти лет. Как и Oil Red O это наиболее эффективный способ обнаружения отпечатков, собранных в течение месяца до их обнаружения. Несмотря на способность люминесцентной детализации отпечатков определенной возрастной группы и вновь образованных (свежих) с помощью КН, ФП остается эффективным средством обнаружения липидных фракций отпечатков. Поскольку краситель не может быть полностью заменен ФП, его включение в последовательность обнаружения в определенных ситуациях может способствовать выявлению отпечатков, обнаруженных (не обнаруженных) с помощью ФП. Применение КН в заключительной стадии процесса выявления (т.е. после применения ФП) может способствовать увеличению числа отпечатков и качества их визуализации.
[30] См. подробнее: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80.
[31] См.: Cantu A. A., Johnson J. L. Silver physical development of latent prints, in: LeeH. C., Ramotowski R., Gaensslen R. E. Advances in Fingerprint Technology. 2nd ed. Boca Raton: CRC Press LLC, 2001. Р. 85.
[29] См.: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80.
[25] См.: Cantu A. A., Johnson J. L. Silver physical development of latent prints, in: Lee H. C., Ramotowski R., Gaensslen R. E. Advances in Fingerprint Technology. 2nd ed. Boca Raton: CRC Press LLC, 2001. Р. 85.
[26] См. подробнее: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80.
[27] См.: Beaudoin A. Fingerprint staining technique on dark and wetted porous surfaces: Oil Red O and rhodamine 6G // Journal of Forensic Identification. 2012. Vol. 62. Iss. 4. P. 315–329.
[28] См. подробнее: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80.
[21] См.: McLaren C., Lennard C., Stoilovic M. Methylamine pretreatment of dry latent fingermarks on polyethylene for enhanced detection by cyanoacrylate fuming // Journal of Forensic Identification. 2010. Vol. 60. Iss. 2. P. 199–222.
[22] См.: Cove J. H., Holland K. T., Cunliffe W. J. An analysis of sebum excretion rate, bacterial population and the production rate of free fatty acids on human skin // British Journal of Dermatology. 1980. Vol. 103. Iss. 4. P. 383–386; Downing D. T. Lipolysis by Human Skin Surface Debris in Organic Solvents // Journal of Investigative Dermatology. 1970. Vol. 54. Iss. 5. P. 395–398; Downing D. T., Strauss J. S., Norton L. A., Pochi P. E., Stewart M. E. The time course of lipid formation in human sebaceous glands // Journal of Investigative Dermatology. 1977. Vol. 69. Iss. 4. P. 407–412; Downing D. T., Marples R. R., Kligman A. M. Control of Free Fatty Acids in Human Surface Lipids by Corynebacterium Acnes // Journal of Investigative Dermatology. 1971. Vol. 56. Iss. 2. P. 127–131.
[23] См.: Croxton R. S., Baron M. G., Butler D., Kent T., Sears V. G. Variation in amino acid and lipid composition of latent fingerprints // Forensic Science International. 2010. Vol. 199. Iss. 1–3. P. 93–102.
[24] См.: Downing D. T. Lipolysis by Human Skin Surface Debris in Organic Solvents // Journal of Investigative Dermatology. 1970. Vol. 54. Iss. 5. P. 395–398.
[32] См. подробнее: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80.
[33] См. подробнее: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80.
[34] См.: Boysen T. C., Yanagawa S., Sato F., Sato K. A modified anaerobic method of sweat collection // Journal of Applied Physiology Respiratory Environmental and Exercise Physiology. 1984. Vol. 56. Iss. 5. P. 1302–1307; Downing D. T., Greene R. S., Pochi P. E., Strauss J. S. Anatomical Variation in the Amount and Composition of Human Skin Surface Lipid // Journal of Investigative Dermatology. 1970. Vol. 54. Iss. 3. P. 240–247.
[20] См.: Sears V. G., Bleay S. M., Bandey H. L., Bowman V. J. A methodology for finger mark research // Science and Justice. 2012. Vol. 52. Iss. 3. P. 145–160.
[18] См.: Champod C., Lennard C. J., Margot P., Stoilovic M. Fingerprints and other ridge skin impressions. 2004. URL: https://archive.org/stream/Fingerprints_and_Other_Ridge_Skin_Impressions/Fingerprints_and_Other_Ridge_Skin_Impressions_djvu.txt (дата обращения: 13.07.2016).
[19] См.: McLaren C., Lennard C., Stoilovic M. Methylamine pretreatment of dry latent fingermarks on polyethylene for enhanced detection by cyanoacrylate fuming // Journal of Forensic Identification. 2010. Vol. 60. Iss. 2. P. 199–222.
[14] См.: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80; Davis M. M., Helzer H. B. Titrimetric and Equilibrium Studies Using Indicators Related to Nile Blue A.// Anal. Chem. 1966. Vol. 38. Iss. 3. P. 451–461; Yablon D. G., Schilowitz A. M. Solvatochromism of Nile Red in Nonpolar Solvents // Appl. Spectrosc. 2004. Vol. 58. Iss. P. 843–847.
[15] См.: Saunders G. Notes on the use of nile red, dansyl chloride, a modified physical developer, and the ITEK RS process for visualizaing latent prints, in: Presented at the U. S. Service Forensic Laboratory. 1993.
[16] См.: Deye J. F., Berger T. A., Anderson A. G. Nile Red as a solvatochromic dye for measuring solvent strength in normal liquids and mixtures of normal liquids with supercritical and near critical fluids // Anal. Chem. 1990. Vol. 62. Iss. 6. P. 615–622.
[17] См. подробнее: Cantu A. A., Maynard P., Lennard C., Roux C. Nile red: Alternative to physical developer for the detection of latent fingermarks on wet porous surfaces? // Forensic Science International. 2013. Vol. 230. Iss. 1–3. P. 74–80.
[10] См.: Salama J., Aumeer-Donovan S., Lennard C., Roux C. Evaluation of the fingermark reagent oil red O as a possible replacement for physical developer // Journal of Forensic Identification. 2008. Vol. 58. Iss. 2. P. 203–237.
[11] См.: Saunders G. Notes on the use of nile red, dansyl chloride, a modified physical developer, and the ITEK RS process for visualizaing latent prints, in: Presented at the U. S. Service Forensic Laboratory. 1993.
[12] См.: Greenspan P., Mayer E. P., Fowler S. D. Nile red: a selective fluorescent stain for intracellular lipid droplets // JCB. 1985. Vol. 100. Iss. 3. P. 965–973.
[13] См.: Ramotowski R. Composition of latent print residue, in: Lee H., Ramotowski R., Gaensslen R.E. (Eds.) Advances in Fingerprint Technology. 2nd ed. Boca Raton: CRC Press LLC, 2001.
[6] См.: Guigui K., Beaudoin A. The use of Oil Red O in sequence with other methods of fingerprint development // Journal of Forensic Identification. 2007. Vol. 57. Iss. 4. P. 550–581; Wood M. A., James T. ORO. The Physical Developer replacement? // Science and Justice. 2009. Vol. 49. Iss. 4. Р. 272–276.
[5] См.: Beaudoin A., Rawji A. Oil red O versus physical developer on wet papers: A comparative study // Journal of Forensic Identification. 2006. Vol. 56. Iss. 1. P. 33–54; Guigui K., Beaudoin A. The use of Oil Red O in sequence with other methods of fingerprint development // Journal of Forensic Identification. 2007. Vol. 57. Iss. 4. P. 550–581.
[8] См.: Beaudoin A. New technique for revealing latent fingerprints on wet, porous surfaces: Oil red O // Journal of Forensic Identification. 2004. Vol. 54. Iss. 4. P. 413–421.
[7] См.: Guigui K., Beaudoin A. The use of Oil Red O in sequence with other methods of fingerprint development // Journal of Forensic Identification. 2007. Vol. 57. Iss. 4. P. 550–581; Salama J., Aumeer-Donovan S., Lennard C., Roux C. Evaluation of the fingermark reagent oil red O as a possible replacement for physical developer // Journal of Forensic Identification. 2008. Vol. 58. Iss. 2. P. 203–237; Wilson J. D., Cantu A. A., Antonopoulos G., Surrency M. J. Examination of the Steps Leading up to the Physical Developer Process for Developing Fingerprints // Journal of Forensic Science. 2007. Vol. 52. Iss. 2. P. 320–329; Yablon D. G., Schilowitz A. M. Solvatochromism of Nile Red in Nonpolar Solvents // Appl. Spectrosc. 2004. Vol. 58. Iss. P. 843–847.
[2] См.: Champod C., Lennard C. J., Margot P., Stoilovic M. Fingerprints and other ridge skin impressions. 2004. URL: https://archive.org/stream/Fingerprints_and_Other_Ridge_Skin_Impressions/Fingerprints_and_Other_Ridge_Skin_Impressions_djvu.txt (дата обращения: 13.07.2016).
[1] Физический проявитель — водный раствор на основе серебра, вступающий в реакцию с жировыми компонентами потовыделений следов пальцев, формируя серебряно-серый налет. Эффективно применяется на пористых поверхностях, таких как: разного типа бумага, картон, сырая древесина, адгезивные ленты на бумажной основе и некоторые искусственные волокнистые материалы. Физический проявитель редко применяется как первичный метод выявления невидимых следов, чаще — как вторичная обработка после проявления нингидрином или ДФО. Поскольку он вступает в реакцию с жировыми компонентами, то часто проявляет дополнительные следы или детали следов, которые не проявились при других методах обработки, использующих реакцию с аминокислотами. Физический проявитель не предназначен для применения на непористых поверхностях.
[4] См.: Beaudoin A. New technique for revealing latent fingerprints on wet, porous surfaces: Oil red O // Journal of Forensic Identification. 2004. Vol. 54. Iss. 4. P. 413–421; Guigui K., Beaudoin A. The use of Oil Red O in sequence with other methods of fingerprint development // Journal of Forensic Identification. 2007. Vol. 57. Iss. 4. P. 550–581; Wood M. A., James T. ORO. The Physical Developer replacement? // Science and Justice. 2009. Vol. 49. Iss. 4. Р. 272–276.
[3] См.: Cantu A. A., Johnson J. L. Silver physical development of latent prints, in: H. C. Lee, Ramotowski R., Gaensslen R. E. Advances in Fingerprint Technology. 2nd ed. Boca Raton: CRC Press LLC, 2001. Р. 85; Jonker H., Molenaar A., Dippel C. J. Physical Development Recording Systems: III. Physical Development // Photogr. Sci. Eng. 1969. Vol. 13. Iss. 2. Р. 38–44; Houlgrave S., Andress M., Ramotowski R. Comparison of different physical developer working solutions — Part I: Longevity studies (Conference Paper) // Journal of Forensic Identification. 2011. Vol. 61. Iss. 6. P. 621–639.
[9] См.: Beaudoin A. New technique for revealing latent fingerprints on wet, porous surfaces: Oil red O // Journal of Forensic Identification. 2004. Vol. 54. Iss. 4. P. 413–421; Wilson J. D., Cantu A. A., Antonopoulos G., Surrency M. J. Examination of the Steps Leading up to the Physical Developer Process for Developing Fingerprints // Journal of Forensic Science. 2007. Vol. 52. Iss. 2. P. 320–329.
§ 1.2. Применение матрично-активированной лазерной десорбции/ионизации для определения фармацевтических препаратов и взрывчатых веществ в отпечатках пальцев
В последнее время эксперты США для оптимизации экспертной деятельности в дактилоскопических исследованиях используют новые методы и средства, акцентируя внимание на необходимости химического анализа потожирового вещества отпечатков пальцев (далее — ПЖВ) для получения информации диагностического характера. Современная западная концепция «химии прикосновения» формирует предпосылки к проведению анализа веществ, содержащихся в отпечатках. Отечественная научная дактилоскопическая литература содержит методы и средства, способствующие установлению большой группы компонентов ПЖВ и решению экспертных идентификационно-диагностических задач (Т. Ф. Моисеева и др.). Современные зарубежные подходы способствуют установлению лица, оставившего следы, его пола и примерного возраста. Выдвижению версий о том, что лицо прикасалось руками к фармацевтическим препаратам и взрывчатым веществам реализуя преступный умысел35.
В ранних исследованиях, характеристика компонентов отпечатков основывалась на использовании методов: инфракрасной микроспектроскопии Фурье (FTIR)36, газожидкостной хроматографии масс-спектрометрии (GC/MS)37, флуоресцентной микроскопии38, десорбции c электрораспылением ионизации масс-спектрометрии (DESI/МС)39, вторичных ионов масс-спектрометрии (SIMS)40. Альтернативный подход, заключается в анализе компонентов эндогенных и экзогенных химических веществ с помощью метода МАЛДИ41. Анализ изображений, полученных в ходе применения метода МАЛДИ позволяет эксперту сделать обоснованный вывод относительно состава ПЖВ в аспекте исследования фармацевтических препаратов и взрывчатых веществ. Если же остаток расположен слева от точек контакта, то после прикосновения к исследуемой группе объектов, изображение рассредоточивается неравномерно по отпечатку. Исследования продемонстрировали значение «сенсорной химии», в частности, в контексте разрешения вопросов о том, курит ли лицо, употребляет ли наркотики, имеет ли отношение к изъятым веществам. Для интеграции «сенсорной химии» с другими методами, должны быть рассмотрены положения методики МАЛДИ.
Дополнительные исследования отпечатков пальцев совместимые с МАЛДИ, необходимы для включения химического анализа в текущие процессы по диагностическому анализу скрытых отпечатков. МАЛДИ используется для выявления соединений в отпечатках. Выбранные группы исследуемых объектов с различными химическими характеристиками были обработаны и проанализированы исследователями. Цели исследования американских специалистов заключались в: 1) создании эффективных методов обнаружения в лабораторных условиях компонентов наркотических средств и взрывчатых веществ в отпечатках, 2) определении целесообразности обнаружения наркотических средств и взрывчатых веществ после непродолжительного контакта рук подозреваемого с таблеткой и (или) порошком.
В 2013 году К. Каплан в составе рабочей группы адаптировала метод химического анализа (Вашингтонский государственный университет США) в целях изучения ПЖВ отпечатков. Матрично-активированная лазерная десорбция/ионизации (далее — МАЛДИ) ранее применялась для определения бактериальной видовой принадлежности. Впоследствии, были изобретены средства диагностирования микроорганизмов на микроуровне. В России названный метод используется исключительно в медицинских и биологических целях. Отсутствие практики применения метода МАЛДИ в судебно-экспертной практике, заставило нас обратить внимание на зарубежный опыт в данной сфере.
К. Каплан и ее коллеги, провели эксперимент, в котором использовались химикаты и материалы группы Advil ® (200 мг ибупрофена в таблетках), Tylenol1 дополнительные материалы (500 мг таблеток ацетаминофена), Bayer1 (81 мг таблеток аспирина), и Sudafed1 24 ч (240 мг псевдоэфедрина гидрохлорид в таблетках), приобретенные у CVS1. На основе информации, содержащейся на этикетке массовая доля (вес наркотиков / общий вес таблетки 100) для каждой таблетки: равна 76% ацетаминофена в Tylenol1, 64% псевдоэфедрина гидрохлорид в Sudafed1, 79% аспирина в Bayer1 и 42% ибупрофена в Advil1. Также эксперт использовал тринитротолуол (TNT), воду и другие вспомогательные вещества (черный дактилоскопический порошок и другие вспомогательные средства).
На первой стадии эксперимента все участники вымыли руки с мылом, затем обработали спиртовым раствором. Для насыщения отпечатков и перенесения ПЖВ, участники должны были предварительно касаться пальцами носа и шеи. Затем требовалось разделить на две части таблетки аспирина, ибупрофена и ацетаминофена для имитации приема препарата. Выполнялась обработка отпечатков. Из веществ получили соединения псевдоэфедрина, прокаина, ТНТ (TNT), и гексогена (RDX). Прокаин и псевдоэфедрин использовался для имитации кокаина и метамфетамина. ТНТ и RDX использовались в качестве примеров взрывчатых веществ. Количество для начальных исследований варьировалось: 1,3, 13, 130, 1300, 2500 мг. Образцы синтезировались с CHCA (α-Циано-4-гидроксикоричная кислота) в соотношении 1:1. Для экспериментов использовалось 1300 мг псевдоэфедрина, гидрохлорида и прокаина, 2500 мг TNT и RDX. Три группы веществ разного объема (по 1, 5 и 10 мл) переносились на следовоспринимающий объект (стекло) и хранились до полного высыхания. Отпечатки наносились примерно за 30 минут до их обработки дактилоскопическим порошком. После, переносились с помощью дактилоскопических средств. Образцы закреплялись на слайде с алюминиевым покрытием. Misonix1 CA-3000 комната (70% влажности) использовалась в соответствии с планом эксперимента. Пластина нагревателя накаливалась до 300 градусов по Цельсию, затем давалось 5 минут на ее выравнивание. После того как пластина и влажность достигли искомых показателей, на нее нанесли 2 грамма цианоакрилата (компонент клея). После проведенной подготовки, воздух в комнате очищался в течение 10 минут. Обработанные термально отпечатки проявлялись дактилоскопическим порошком. На стадии подготовки TM-Sprayer (часть МАЛДИ технологии) использовался для растворения 5 мг/мл α-Циано-4-Гидроксикоричной кислоты (30:70 вода: ацетонитрил (ACN) с 0,1% уксусной кислоты. Система матрицы защищалась от попадания пузырьков в систему опрыскивателя (опрыскиватель может распылять 5 мл раствора при температуре 115 градусов по Цельсию). Образцы, подвергаемые распылению, предварительно высушивались.
МАЛДИ позволяет анализировать 4 слайда одновременно. Слайды устанавливаются на держатель с помощью двухсторонней углеродной клейкой ленты. При анализе образцов используется лазер типа N2 (337 нм). Диапазон сканирования и другие параметры, устанавливаются индивидуально для каждого образца. Максимальный диапазон составляет 0–1200 m/z. Устройство выдает высококачественную картинку 70 на 20 мм из 62,578 точек. Лазер делает 2 снимка распределяя вещества по иерархии. Для эффективного режима исследований проходимость устанавливается в 65 m/z. Исследование четырех сканов отпечатков заняло около 4 часов. Далее изображение обрабатывалось с помощью программного обеспечения Shimadzu Biotech MALDIMS и BioMap (Швейцария), адаптированного для определения исследуемой группы объектов в отпечатках пальцев.
В результате эксперимента с помощью МАЛДИ определили искомые вещества, оставшиеся в отпечатках пальцев лиц. Подтверждено, что МАЛДИ — безопасный метод, не разрушающий компоненты ПЖВ отпечатка. Образцы анализировались таким образом, чтобы была возможность их дальнейшего изучения, без разрушения компонентов ПЖВ. Существуют ограничения, связанные с применением метода МАЛДИ. Первое связано с необходимостью соблюдения лабораторных условий стерильности. На месте происшествия такие условия не могут быть созданы в силу объективных причин, что может привести к сбоям в определении веществ или ошибкам приборов в виду наличия в отпечатках инородных компонентов ПЖВ. Эксперимент способствовал получению качественного изображения, на котором можно было детально распознать виды папиллярных узоров исследуемого отпечатка. В процессе исследования появилась возможность установления отдельных элементов преступной деятельности (употребления наркотиков, изготовления взрывчатых веществ). Следующее ограничение связано с ресурсоемкостью метода МАЛДИ. Он требует временных затрат и высокого уровня экспертных технологий, что не всегда возможно обеспечить в условиях деятельности экспертных подразделений местного или регионального уровня органов внутренних дел. В силу указанных обстоятельств применение МАЛДИ в отечественной судебно-экспертной практике может способствовать решению диагностических задач.
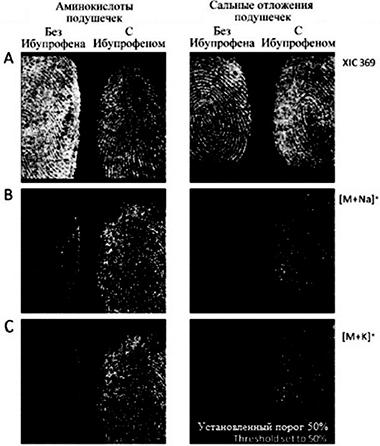
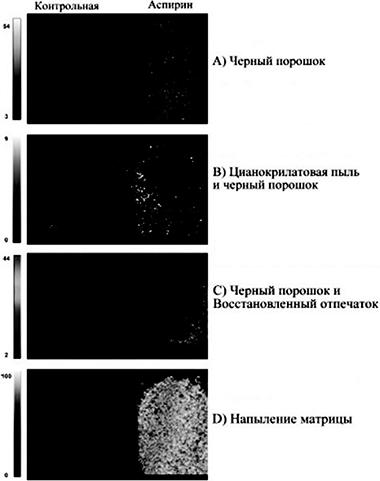
Рис. 1. Механизм визуализации следов пальцев рук42
§ 1.3. Определение состава потожирового вещества детских отпечатков пальцев с использованием инфракрасной микроспектроскопии с преобразованием Фурье
Несмотря на усилия, предпринятые государствами в сфере защиты прав и законных интересов несовершеннолетних от преступных посягательств, отдельные проблемы, связанные с расследованием преступлений данной группы лиц, до настоящего времени не нашли своего разрешения. В теории судебной экспертизы и криминалистики исследования по изучению следов пальцев рук несовершеннолетних до недавнего времени не включали в предмет исследования вопросы, касающиеся восстановления отпечатков, поскольку отсутствовала возможность установления причин и механизмов деградации следов данной группы. В этом аспекте американские исследования вносят вклад в установление обстоятельств деградации отпечатков с использованием инфракрасной микроспектроскопии для безопасного определения состава компонентов потожирового вещества (далее — ПЖВ) взрослых и детей (1–11 лет).
В анализируемых работах отмечается проблема обнаружения детских отпечатков на месте происшествия. При этом авторы имеют ввиду отпечатки, не наблюдаемые без специальных технико-криминалистических средств (дактилоскопических средств). Эксперты высказывают предположения относительно причин исчезновения следов данной группы. По их мнению, в детских отпечатках содержится иной химический состав ПЖВ, исследуя которое может устанавливаться давность отображения отпечатка. Отпечатки взрослых сохраняют идентификационное значение значительно дольше, чем несовершеннолетних, поскольку содержащийся в их потожировом веществе состав имеет быстро исчезающие компоненты. Эксперты полагают, что определив компоненты состава ПЖВ возможно установить элемент, обладающий признаками наибольшей устойчивости, которые впоследствии могут лечь в основу метода восстановления отпечатков несовершеннолетних.
Вклад американских коллег в изучении данного вопроса заключается в определении химического состава ПЖВ отпечатков несовершеннолетних. Используемый метод — инфракрасная микроспектрометрия, способствует восстановлению отпечатка без разрушительного воздействия на остатки компонентов ПЖВ. Дактилоскопистами США инициированы исследования для определения характеристик компонентов, содержащихся в остатках ПЖВ. По авторскому предположению в случае определения химического состава отпечатка несовершеннолетнего (в эксперименте приняло участие 66 детей, возраст которых варьировался от 1–11 лет) возможно создать метод восстановления, поскольку отдельные компоненты ПЖВ восстанавливаются и содержатся длительное время в составе ПЖВ43.
В американской науке отпечатки несовершеннолетних изучаются с середины 90-х годов прошлого века. В указанный период для определения состава ПЖВ использовались газожидкостная хроматография (далее — ГЖХ), на смену которой пришла инфракрасная микроспектроскопия Фурье. Необходимость использования альтернативных методов была вызвана проблемами, возникающими в процессе использования ГЖХ, разрушающей остатки ПЖВ и негативно сказывающейся на идентификационном потенциале исследуемых следов. Д. К. Уильямс разработала метод инфракрасной микроспектрометрии не разрушающий структуру отпечатка44.
Опубликованное в 2011 году исследование, способствовало определению веществ, содержащиеся в отпечатках изучаемой группы лиц. Для экспериментов получены необходимые образцы (у детей возрастной группы от 1 до 11 лет). Перед применением инфракрасного анализа отпечатки рассматривались с помощью 4-кратного увеличения и объектива на инфракрасном микроскопе «Континуум». Как только интересующая исследователей область была определена, оттиски отпечатка стало возможно наблюдать, используя 32-кратное увеличение объектива Reflechromat на инфракрасном микроскопе «Континуум», соединяющегося с «Нексус 760 (Термо Фишер) спектрометром FT-IR». Исследователями отбиралась одна капля или частица от края отпечатка, отверстие для сбора инфракрасных спектров регулировалось в соответствии с их размером. Спектры собирались с разрешающей способностью в 4 см и усредненными данными для 128 просмотров. Охлажденный жидким азотом MCT-высокий D* детектор с диапазоном чувствительности 4000–800 см-1 использовался для обеспечения гарантий его высокой чувствительности. После того как необходимые спектры были собраны, класс компонентов для каждой отдельной частицы или капли определили, основываясь на полученных спектральных профилях.
Вслед за распределением спектра по конкретным классам компонентов каждый спектр исследовался в нескольких доступных базах, составивших пакет программного обеспечения OMNIC. При этом исследовательские базы не использовались в целях распределения конкретной капли или частицы по определенным классам компонентов. Полученные выводы сделаны посредством анализа спектральных особенностей. Совпадения, обнаруженные в базе, использовались для вторичного подтверждения. В дополнение к данным FTIR специалисты консультировались с экспертом в области хроматографического разделения веществ для подтверждения идентичности компонента, представляющего интерес.
В целях изучения остатков отпечатка по истечении длительного времени с момента помещения на следовоспринимающий объект, точечные карты капель/частиц создавались с помощью программного обеспечения OMNIC с отображающей способностью Atlus. Функция отображения Atlus позволяет создать файлы карты, обеспечивая их сохранность, для гарантии точной повторной выборки капли. В результате использования точечных карт, стало возможно внести изменения в спектр частицы/капли от края отпечатка, который изымается (используя аналогичные экспериментальные параметры) каждые 24 часа. Результаты изменений в оценке спектральной поглощательной способности компонентов класса, обнаруженные в отдельной капле или частице, основывались на временных параметрах. Полученный спектр анализировался, после чего оценки спектральной поглощательной способности для каждого класса компонентов, определяемые с помощью характерных связей, вносились в базу Microsoft Access 1 для упрощения процедур сопоставления. Для статистического соответствия спектры собирались в основном из пяти капель от каждого края отпечатка и, по крайней мере, трех краев в пределах каждого отпечатка наносились на карту. В целях определения изменений поглощательной способности по истечении времени, области под кривой каждой точки получены и усреднены, чтобы сообщать об отклонениях, характерных для каждого компонента, представляющего интерес.
Температурные исследования. Стекла с алюминиевым покрытием, содержащие оттиски отпечатков детей нагревались в сушильной печи при 50, 60, 70 градусах по Цельсию в течение 72 часов. После извлечения, остатки отпечатка анализировались с помощью инфракрасной микроспектроскопии. Для контроля набор оттисков отпечатков был сохранен исследователями. Общее количество детей, оставивших для исследования отпечатки составило 27 (13 мужского пола и 14 женского), в возрастном промежутке от 1 до 9 лет. У каждого ребенка, получено 3 отпечатка при минимальном количестве собранных спектров 45. После сбора данные помещались в базу Microsoft Access 1 для упрощения сопоставления. Оценки спектральной поглощательной способности определялись при получении данных пиковых областей изменения в спектральной поглощательной способности, изменения в процентном соотношении сложных эфиров и карбоксильных кислотных солей. Вслед за вычислением процентного соотношения, среднее число температурных изменений в процентном соотношении определено наряду с соответствующими стандартными отклонениями.
Два микрофотоснимка (4) остатков ПЖВ, полученные с отпечатков с сальным и экзокринным материалом (перед мытьем) 5-летней девочки и 24-летней девушки на рис. 1. Два существенных отличия оттисков отпечатка состоят в количестве размещенных остатков (соотношения капель к частицам). В целом отпечатки взрослых содержали тяжелые остатки в компонентах ПЖВ, отпечатки нескольких детей (все женского пола возрастом от 5 до 9 лет) напоминали отпечатки взрослых. На основании этого исследователи высказали предположение, что женщины ближе к достижению физиологических изменений, сопровождающих их половую зрелость, чем ровесники сходной возрастной группы. Оттиски отпечатков взрослых содержали высокое соотношение твердых частиц к каплям. Это открытие проявилось во всем наборе образцов.

Рис. 1. Отпечатки пальцев рук несовершеннолетнего и совершеннолетнего лица45
Микрофотоснимок (с пометкой «точечная карта») соответствующий спектрам остатка, полученного из отпечатка с сальным и экзокринным материалом (после мытья) 5-летней женщины показан на рис. 2. Пункты, отмеченные цифрами 1 и 4 на микрофотоснимке, иллюстрируют особенности, проявившиеся в избытке на отпечатках с сальным и экзокринным материалом: частицы и капли. В процессе определения результатов инфракрасной микроспектрометрии ось X измерена для выявления деталей спектра в области, составляющей 800–2000 см. Для определения класса компонентов капли 5 анализировались пиковые положения и их интенсивность. Пункт B на микрофотоснимке обозначает положение на заднем плане; спектр на заднем плане задокументирован для каждой точной карты. Наиболее заметная особенность в спектре, маркированном «а», — C–H продолжительная вибрация ниже 3000 см.
При 1741 см пик, соответствующий продолжительной вибрации карбонила, является очевидным и содержит выступ на уровне 1713 см, который, вероятно, образован из-за присутствия второго способа «карбонильного протяжения».
При 1463 см есть пик, соответствующий ассиметричному изгибу из метила, и в 1175 см-1 там — маленький пик, характерный для C–O протяжения сложного эфира. Распределение пиков предполагает, что химический состав капли (пункт 5) на рис. 2 является смесью, содержащей сложный эфир и влажный кетон. Для определения химического состава темной частицы (пункт 4), показанной в спектре, маркированном как «b» на рис. 2, пики распределялись из соответствующего спектра. Заметная особенность в спектре — простирающаяся вибрация при 3281 см, характерная для N–H метода протяжения. Пик, появляющийся в 1655 см-1, указывает на способ протяжения C55O, a пик в 1546 см-1, что N–H в плоскости изгиба, и пик в 1233 см-1 указывают на протяжение C–N. Распределение пиков предполагает присутствие вторичного амида, характерного для клеток кожи с содержанием белка. Собранные остатки отпечатка содержали частицы с соответствующими спектральными профилями.
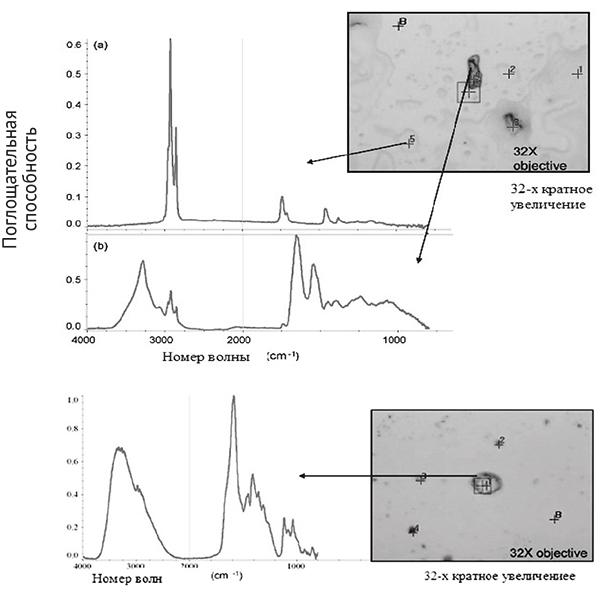
Рис. 2–2а. Изображение с 32-кратным увеличением фрагментов отпечатка пальца46
Микрофотоснимок и соответствующий спектр остатка отпечатка с экзокринным материалом 7-летней девочки показан на рис. 3. Отпечаток получен после мытья рук с мылом, полоскания в течение 1 минуты, тщательной сушки и перенесения отпечатка на следовоспринимающую поверхность. Для определения химического состава капли (пункт 1), положение и интенсивность пиков сравнивалось со спектрами биологического состава (Сигма). Соответствующий компонент соли натрия молочной кислоты последовательно получался в спектре с аналогичными отличительными признаками как тот, что показан на рис. 3.
Спектральная база использовалась в дополнение для подтверждения выводов, что капля являлась солью. Начальная характеристика выявлена путем распределения пиков в инфракрасном спектре в специальные функциональные группы. Эти результаты подтверждены Л. Льюис в Окриджской национальной лаборатории. Используя ГЖХ Л. Льюис выявила присутствие соли натрия молочной кислоты в детских отпечатках47. Для определения степени различий состава отпечатка детей не достигших половой зрелости, несколько наблюдений сделаны после анализа и определения взаимосвязи. Во-первых, дети, у которых отбирали отпечатки, имели три отличных группы компонентов, присутствующих в их отпечатках: а) сложные эфиры, б) вторичные амиды (частицы белка), в) кислотные соли. В то время как некоторые отпечатки содержали кетонную функциональность, кетон не последовательно выявлялся в их ПЖВ, поэтому не установлена взаимосвязь между присутствием кетона и определением пола, а также возрастной группой отпечатков исследуемого лица. Во-вторых, тенденция наблюдалась в процессе исследования лиц не достигших половой зрелости: оттиски отпечатка состояли из соли натрия молочной кислоты (рис. 3).
Для сравнения по половому признаку, спектры остатков отпечатков с экзокринным материалом, полученные от 7-летнего мальчика и 7-летней девочки, показаны на рис. 4. Остатки отпечатка отобраны после мытья. Спектры отбирались с использованием аналогичных экспериментальных параметров. Результаты указывают на то, что остатки химически идентичны и идентифицируются как соль натрия молочной кислоты.
Липиды кожной поверхности детей изучались хроматографическими методами, предложенными Стюартом, Даунингом, Куком, Хансен и Штрауссом48. Исследователи заключили, что состав липидов не всегда содержит сальный материал. Результаты подтверждают присутствие сложных эфиров в оттисках отпечатков исследуемой группы, спектра из свободного холестерина не наблюдалось в более 16,000 спектрах, полученных для исследования. Кроме того, исследователи определили, что большинство девочек, участвующих в исследовании (возраст — 5 лет) имели больший объем сального материала в ПЖВ в отличие от мальчиков.
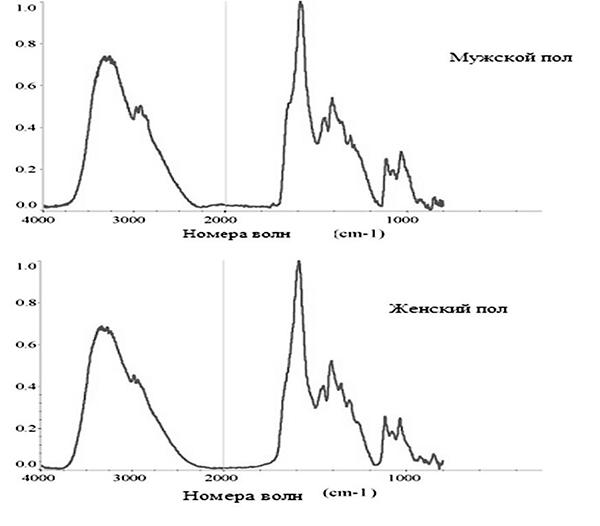
Рис. 3. Микрофотоснимок и спектр, полученные из оттиска отпечатка 7-летней девочки. Числа с крестами указывают на отображение местоположения и +B указывает на область заднего плана49
Результаты, показанные на рис. 5, указывают, что спектральная поглощательная способность остатка сложного эфира, полученного у 5-летней девочки уменьшается на 95% за исследуемый временной интервал. Результаты указывают, что соли стабильны в течение исследуемого периода в отличие от сложных эфиров. Итоги исследования, показанные на рис. 5, характеризуют изменения, характерные для всех его участников, кроме основанного на разнице в возрасте сравнения, невозможного из-за разнообразия в объеме исследуемого материала, влияющего на уровень изменений, не подлежащих сопоставлению.
Сбор данных продолжается, поэтому прогнозирование результатов имеет перспективу. В процессе исследования установлено, что остатки ПЖВ детских отпечатков, собранные и сохраненные в течение 6 лет содержат значительный объем солей, которые могут анализироваться. Исследователями отмечается, что при условии использования высокой температуры, летучесть сложных эфиров ожидаемо увеличивается, тогда как соли остаются относительно постоянными, в связи с чем, они представляют интерес в условиях необходимости формирования методов восстановления отпечатков исследуемой возрастной группы.
Экспериментами подтверждено, что сложные эфиры разрушаются быстрее, чем соли от воздействия температур, поскольку в определенных случаях, после нагревания до 70 °C в течение 72 часов, не остается ни одной капли сложного эфира, тогда как соляные капли визуализируются при микроскопическом исследовании и инфракрасном анализе. Результаты показывают стабильность солей относительно сложных эфиров, поэтому отпечатки исследуемой группы могут восстанавливаться.
В заключение отметим следующее, детские отпечатки, содержат три класса компонентов: а) карбоксильные кислотные соли, б) сложные эфиры, в) вторичные амиды (частицы белка), ранее упоминаемые при описании скрытых отпечатков взрослых50. Существенным отличием между оттисками скрытых отпечатков взрослых и детей является относительное соотношение компонентов края отпечатка. Есть небольшая доля частиц белка (оцениваемая менее чем 1% во всех случаях), составляющая образцы краев детских отпечатков относительно отпечатков взрослых (согласно оценке более чем 5% в некоторых случаях). Поэтому установление белков вряд ли приведет к позитивным результатам в визуализации детских отпечатков. Детский отпечаток содержит сложные эфиры с идентичным химическим составом, как и отпечаток взрослого. Сложные эфиры не являются составляющими компонентами большинства капель, обнаруженных на краях отпечатка. Основным компонентом детских отпечатков является кислотная соль, установленная с помощью анализа FTIR и GC/MS (соль натрия молочной кислоты). Температурное исследование показало, что сложные эфиры нестабильны в отличие от солей. Соли устанавливаются по истечение времени, поэтому, создав методику их восстановления, возможно найти способы к решению проблем, связанных с визуализацией отпечатков несовершеннолетних. Отметим, что, несмотря на прогресс в области изучения возможностей восстановления отпечатков указанной группы, в настоящее время не создана соответствующая методика.
§ 1.4. Исследование следовоспринимающей поверхности для сбора и идентификации следов пальцев рук с применением колориметрического способа обнаружения взрывчатых веществ
По мнению дактилоскопистов США, отпечатки пальцев могут быть классифицированы на три вида: видимые, скрытые и измененные51. Видимые и измененные отпечатки обнаружить относительно просто, в отличие от невидимых, последние не визуализируются без специальных дактилоскопических средств. Скрытые отпечатки пальцев — продукт соединения воды, пота и других выделяемых человеческим организмом веществ. Отпечатки могут содержать и другие химические вещества, если субъект касался каких-либо предметов. Некоторые методы визуализации отпечатков, к сожалению, делают невозможным их дальнейшее экспертное использование52.
Американскими учеными получены определенные позитивные результаты в обнаружении следов взрывчатых веществ при анализе потожирового вещества отпечатков пальцев рук. Необходимые для суда, так называемые апробированные методы, являются достаточно сложными, а методики их применения требуют высокочувствительных и финансово-затратных методов, таких как жидкостная хроматография (ЖХ), газовая хроматография-масс-спектрометрия (ГХ/МС)53. Названные методы необходимы судебной системе, поскольку в процессе установления объективных обстоятельств по делу, время и финансы не имеют определяющего значения. На месте преступления используются для решения оперативных экспертных задач презумптивные методы, являющиеся менее точными и затратными. Ограничение их применения в лабораторных условиях больше связано с отсутствием инновационных технологий, чем с невозможностью их осуществления.
В американской литературе по дактилоскопии обращается внимание на то, что в последнее время исследования по изучению процессов синтеза материалов значительно продвинулись, но до сих пор в судебных науках эти достижения не используются должным образом. При этом их экспериментальное использование привело к положительным результатам. В ряде случаев, для визуализации и обнаружения наркотических средств или взрывчатых веществ в составе потожирового вещества отпечатков использовались квантовые точки (КТ) и покрытые антителами наночастицы54. Одни методики для выявления веществ в составе потожирового вещества отпечатка требуют добавления к реагенту покрытых антителами наночастиц, другие — основываются на использовании масс-спектрометрической визуализации для проявления отпечатков и обнаружения экзогенных соединений. Однако данные методы требуют, чтобы либо сам отпечаток был перенесен на поверхность, подходящую для масс-спектрометрии, либо нанесения матрицы на него55.
Авторы рассмотрели возможность предварительного изменения поверхности, на которой затем отображается отпечаток56. Их цель состояла в создании фундаментального исследования, касающегося проблем и направлений поиска способов изменения поверхности для создания сканера отпечатков, способного запечатлевать отпечаток и обнаруживать на нем вещества, запрещенные в свободном обороте. Исходя из практической целесообразности, первоначально использовалось стекло, поверхность которого изменялась с помощью двух типов реагентов. 9,10-дифенилантрацен (DPA), представляющий собой ультрафиолетовый реактивный краситель, выбранный для визуализации отпечатка. Для определения присутствия нитрата мочевины, (первичного компонента в самодельных взрывных устройствах) использовали p-диметиламинобензальдегид (p-DMAB) или p-диметиламиноциннамальдегид (p-DMAC)57 (рис. 1).
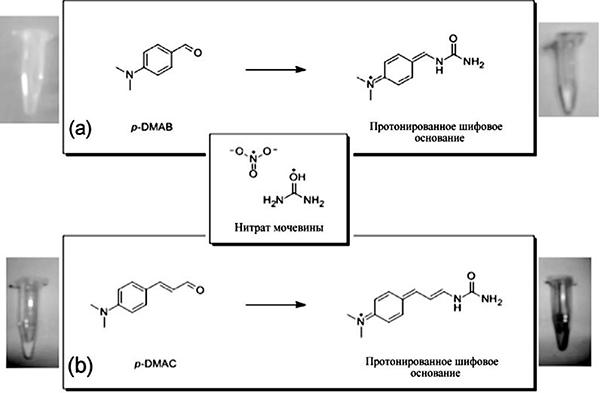
Рис. 1. Химическое обнаружение нитрата мочевины: а) реакция р-диметиламинобензальдегида (p-DMAB), (бежевый) с нитратом мочевины с образованием желтого пигмента; b) реакция p-диметиламиноциннамальдегида (p-DMAC) (оранжево-желтого цвета) с нитратом мочевины с образованием темно-красного пигмента58
Необходимые для исследования реагенты получены из Sigma-Aldrich (St Louis, MO). Нитрат мочевины приготовлен посредством инициации реакции концентрированной азотной кислоты с насыщенным раствором мочевины59. Раствор 0,1% DPA готовился в воде и обрабатывался ультразвуком до полного растворения. В этаноле были приготовлены растворы в количестве 0,4% p-DMAB и 0,4% p-DMAC60. Аликвоту по 1 мл каждого раствора испытывали с каплей 0,1 моль (М) нитрата мочевины. Оба раствора были одинаково протестированы с помощью 0,1 моль (М) мочевины и 6,0 моль (М) азотной кислоты.
Стеклянные слайды очищались с помощью этанола, затем подвергались ультрафиолетовому излучению. Аликвоту раствора DPA (ДПА) помещали на слайд и давали высохнуть в течение 5 минут. Отпечатки, на поверхности которых отсутствовал нитрат мочевины, прикладывались на такие слайды. После слайды покрывались растворами с различными концентрациями p-DMAC или p-DMAB. Растворы наносились двумя способами: 1) в центр слайда помещали 4–5 капель раствора и давали высохнуть; 2) слайд полностью покрывался раствором, затем высушивался. Для контроля один чистый отпечаток был нанесен на каждый из типов слайдов. Несколько капель 0,5 моль (М) нитрата мочевины в этаноле наносили на чистый палец и давали высохнуть на воздухе. Затем такой палец переносился на стеклянный слайд. Стеклянные слайды полностью покрывали растворами p-DMAC или p-DMAB (0,4%), а затем высушивали. После применяли 0,1% раствор DPA и давали ему высохнуть. Маленький кристалл нитрата мочевины при этом рассыпался между большим и указательным пальцами, а затем ставился отпечаток. УФ-снимки выполнялись с помощью Perkins Elmer GelianceTM 600 Imaging System (759) или Mytouch 4G slide с 8,0-мегапиксельной камерой.
Первоначально краситель и реагенты тестировались индивидуально, затем их синтезировали. В результате использования нескольких растворителей (ацетона и этанола) установлено, что вода более предпочтительна для растворения DPA, хотя из-за ее применения увеличивается время высыхания. Небольшой желтый оттенок на поверхности стеклянного слайда подтверждал наличие красителя. Сам по себе DPA (ДПА) допускал визуализацию четких отпечатков, особенно при УФ-свете. Краска прилипала к гребням отпечатка и проступала над флуоресцентным фоном (рис. 2).

Рис. 2. Стеклянные слайды, модифицированные 9,10-дифенилантраценом (DPA): под УФ-светом с отпечатком пальца на слайде (a); свет с отпечатком пальца на слайде (b)61
Для покрытия только p-DMAB или p-DMAC оптимальные концентрации растворов в этаноле устанавливались равными 0,4% для p-DMAB и 0,2% для p-DMAC. 0,4% раствор p-DMAC способствовал образованию крупных кристаллов при высыхании, оставляя области с высокой концентрацией реагентов и областями с малым его количеством или без него. После того, как отпечаток с нитратом мочевины переносился на слайд с p-DMAB, область с таким отпечатком меняла цвет на желтый (рис. 3а). После нанесения отпечатка пальца с нитратом мочевины на слайд с p-DMAC в области его расположения изменялся цвет с бледно-желтого на красный (рис. 3б).

Рис. 3. Отпечаток с нитратом мочевины, помещенный на стекло, покрытый 0,4% p-DMAB в этаноле (a). Отпечаток с нитратом мочевины, нанесенный на стекло, покрытое 0,2% p-DMAC в этаноле (б). Сфотографировано на белой бумаге62
Рис. 4. Стеклянные слайды, преобразованные с помощью 9,10-дифенилантрацена (DPA) и p-DMAC. Видимый свет, присутствие нитрата мочевины отмечается изменением цвета от желтого до красного (a). При УФ-свете DPA показывает отпечаток с увеличенным разрешением (b)63
Рис. 5. Идентификация деталей папиллярного узора отпечатка пальца при УФ-свете (увеличение в 759 р.)64
Полностью покрытый p-DMAC слайд показал лучший результат, чем при использовании 4–5 капель в выбранных областях. По предположению исследователей, это связано с наличием большего количества реагента и равномерным покрытием самого слайда. Несмотря на то что оба слайда с p-DMAB и p-DMAC привели к изменению цвета области контакта с пальцем, четкие детали отпечатка не наблюдались, что связано с большими кристаллами реагента, образовавшимися при выпаривании растворителя.
Объединение DPA и p-DMAC на поверхности не затрагивало и не улучшало индивидуальных особенностей обоих реагентов, перекрестная реакция с реагентами не происходила. На рис. 4 показано изображение с видимым светом отпечатка на слайде, модифицированном как DPA, так и p-DMAC при естественном освещении и под воздействием УФ-лампы. Палец, покрытый измельченными кристаллами нитрата мочевины до нанесения, оставляет красный след под естественным светом. Области, ранее не подвергавшиеся воздействию нитрата мочевины, оставались желтыми. При воздействии УФ-лампы DPA флуоресцирует синий цвет, обеспечивая повышенную четкость. В связи с тем, что p-DMAB становится бледно-желтым при наличии нитрата мочевины и сам DPA бледно-желтый, изменение цвета слайдов, покрытых смесью p-DMAB/DPA при наличии нитрата мочевины, не наблюдалось.
Большинство методик зависят от обработки поверхности, либо от обработки полученных отпечатков65. Основной целью запечатления отпечатка является выделение деталей. Чем больше четкость изображения, тем большее количество деталей можно наблюдать66. На рис. 5 показано УФ-изображение преобразованного слайда при 759-кратном увеличении с 10 идентифицируемыми деталями.
В заключении исследования эксперты отмечают, что в целях экономии времени и финансов, целесообразнее, чтобы лица прикладывали пальцы на предварительно загруженные поверхности, предназначенные для решения определенных целей. Результаты показывают, что можно преобразовать стеклянную поверхность, а затем пронаблюдать ее реакцию во взаимодействии с нужными веществами, одновременно наблюдая детализированный отпечаток. При покрытии p-DMAC стеклянная поверхность с нитратом мочевины стала темно-красной. Однако этот метод еще не может использоваться в реальных условиях, являясь свидетельством реализации принципа модификации поверхности. Установлено, что такой краситель, как DPA, способен обеспечить повышенную четкость отпечатков как при УФ излучении, так и видимом свете. Кроме того, разработан эффективный метод непосредственного применения растворов реагентов, p-DMAB и p-DMAC к стеклянным слайдам, способствующим обнаружению остатков нитрата мочевины на пальцах. Краситель и реагенты могут использоваться совместно, не мешая друг другу. Экспертным путем возможно модифицировать поверхность для обнаружения незаконного соединения и запечатлеть потенциальный отпечаток для решения идентификационных задач.
Нитрат мочевины относительно легко смывается с рук, а p-DMAC иногда подвержен ложному срабатыванию (при этом изменение цвета не самое худшее). Американские специалисты обращают внимание на то, что в предстоящих исследованиях необходимо определить пределы использования метода, если впоследствии он будет внедрен в судебно-экспертную практику. Этот способ модификации смесью реагентов должен быть применимым и к сложным полимерам, таким как полидиметилсилоксаны или поливинилхлорид. Более полное исследование с изучением потожировых частиц отпечатков военнослужащих, работающих с взрывчатыми веществами и взрывными устройствами, может дать уточненное представление о процессах и механизмах протекания указанного взаимодействия. Кроме того, необходимо применять больше различных реагентов и поверхностей для создания устройств лабораторного тестирования (point-of-care devices). В конечном итоге, исследователи стремятся использовать полученные результаты для разработки устройства, способного обнаруживать взрывчатые вещества, такие как гексоген, метаболиты наркотиков в составе потожирового вещества отпечатков.
[40] См.: Bailey M. J., Bright N. J., Croxton R. S., Frances S., Ferguson L. S. Chemical Characterization of Latent Fingerprints by Matrix-Assisted Laser Desorption Ionization, Time-of-Flight Secondary Ion Mass Spectrometry, Mega Electron Volt Secondary Mass Spectrometry, Gas Chromatography/Mass Spectrometry, X-ray Photoelectron Spectroscopy, and Attenuated Total Reflection Fourier Transform Infrared Spectroscopic Imaging: An Intercomparison // Analytical Chemistry. 2012. Vol. 84 (20). P. 8514–8523; Szynkowska M. I., Czerski K., Rogowski J., Paryjczak T., Parczewski A. Detection of exogenous contaminants of fingerprints using ToF-SIMS // Surface and interface analysis. 2010. Vol.42. Iss. 5. P. 393–397.
[41] См.: Benton M., Chua M. J., Gu F., Rowell F., Ma J. Environmental nicotine contamination in latent fingermarks from smoker contacts and passive smoking // Forensic since international. 2010. Vol. 200. Iss. 1–3. P. 28–34; Benton M., Rowell F., Sundar L., Jan M. Direct detection of nicotine and cotinine in dusted latent fingermarks of smokers by using hydrophobic silica particles and MS // Surface and interface analysis. 2009. Vol. 42. Issue 5. P. 378–385; Rowell F., Seviour J., Lim A. Y., Elumbaring-Salazar C. G., Loke J., Ma J. Detection of nitro-organic and peroxide explosives in latent fingermarks by DART- and SALDI-TOF-mass spectrometry // Forensic since international. 2012. Vol. 221. Iss. 1–3. P. 84–91.
[42] См. подробнее: Kaplan-Sandquist K., LeBeau M. A., Miller M. L. Chemical analysis of pharmaceuticals and explosives in fingermarks using matrix-assisted laser desorption ionization/time-of-flight mass spectrometry // Forensic Since International. 2014. Vol. 235. P. 68–77.
[36] См.: Chen T., Schultza Z. D., Levin I. W. Infrared spectroscopic imaging of latent fingerprints and associated forensic evidence // Analyst. 2009. 134. Р. 1902–1904.
[37] См.: Hazarika P., Jickells S. M., Russell D. A. Rapid detection of drug metabolites in latent fingermarks // Analyst. 2009. Vol. 134. P. 93–96.
[38] См.: Hazarika P., Jickells S. M., Russell D. A. Rapid detection of drug metabolites in latent fingermarks // Analyst. 2009. Vol. 134. P. 93–96.
[39] См.: Ifa D. R., Manicke N. E., Dill A. L., Cooks R. G. Latent Fingerprint Chemical Imaging by Mass Spectrometry // Science. 2008. Vol. 321. Iss. 5890. P. 805.
[35] См.: Kaplan-Sandquist K., LeBeau M. A., Miller M. L. Chemical analysis of pharmaceuticals and explosives in fingermarks using matrix-assisted laser desorption ionization/time-of-flight mass spectrometry // Forensic Since International. 2014. Vol. 235. P. 68–77.
[50] См.: Williams D. K., Schwartz R. L., Bartick E. G. Analysis of latent fingerprint deposits by infrared microspectroscopy // Applied Spectroscopy. 2004. 58 (3). P. 313–316.
[51] См.: James S. H., Nordby J. J., Bell S. Forensic Science: An Introduction to Scientific and Investigative Techniques. Boca Raton, FL: CRC Press. 2008. Р. 341–360.
[52] См.: Saferstein R. Fingerprints. In: Mortimer F. Jr., Bosco M., eds. Criminalistics. Upper Saddle River. NY: Pearson. 2011. Р. 426–457; James S. H., Nordby J. J., Bell S. Forensic Science: An Introduction to Scientific and Investigative Techniques. Boca Raton, FL: CRC Press. 2008. Р. 341–360.
[53] См.: Saferstein R. Fingerprints. In: Mortimer F. Jr., Bosco M., eds. Criminalistics. Upper Saddle River. Р. 426–457; James S. H., Nordby J. J., Bell S. Forensic Science: An Introduction to Scientific and Investigative Techniques. Boca Raton, FL: CRC Press. 2008. Р. 341–360; Kiselica S. Principles of instrumental analysis. Orlando, FL: Saunders College Publishing. 2007. Р. 1039; Moore D. S. Instrumentation for trace detection of high explosives // Review of Scientific Instruments. 2004. Vol. 75. Р. 2499; Yinon J. Toxicity and metabolism of explosives. Boca Raton, FL: CRC Press, 2000. Р. 192.
[47] См.: Clarys P., Barel A. Quantitative evaluation of skin lipids // Clinics in Dermatology. 1995. Vol.13. P. 307–321.
[48] См.: Stewart M. E., Downing D. T. Proportions of various straight and branched fatty acid chain types in the sebaceous wax esters of young children // Journal of Investigative Dermatology. 1985. Vol. 84(6). P. 501–503; Stewart M. E., Downing D. T. Unusual cholesterol esters in the sebum of young children // Journal of Investigative Dermatology. 1990. Vol. 95(5). P. 603–606.
[49] См. подробнее: Williams D. K., Brown C. J., Bruker J. Characterization of children’s latent fingerprint residues by infrared microspectroscopy: forensic implications // Journal of Forensic Since International. 2011. Vol. 206. Iss. 1–3. P. 161–165.
[43] См.: Williams D. K., Brown C. J., Bruker J. Characterization of children’s latent fingerprint residues by infrared microspectroscopy: forensic implications // Journal of Forensic Since International. 2011. Vol. 206. Iss. 1–3. P. 161–165.
[44] См.: Williams D. K., Schwartz R. L., Bartick E. G. Analysis of latent fingerprint deposits by infrared microspectroscopy // Applied Spectroscopy. 2004. 58 (3). P. 313–316.
[45] См. подробнее: Williams D. K., Brown C. J., Bruker J. Characterization of children’s latent fingerprint residues by infrared microspectroscopy: forensic implications // Journal of Forensic Since International. 2011. Vol. 206. Iss. 1–3. P. 161–165.
[46] См. подробнее: Williams D. K., Brown C. J., Bruker J. Characterization of children’s latent fingerprint residues by infrared microspectroscopy: forensic implications // Journal of Forensic Since International. 2011. Vol. 206. Iss. 1–3. P. 161–165.
[61] См. подробнее: Cross S. N., Quinteros E., Roberts M. Surface Modification for the Collection and Identification of Fingerprints and Colorimetric Detection of Urea Nitrate // Journal of Forensic Science. 2015. Vol. 60. Iss. 1. P. 193–196.
[62] См. подробнее: Cross S. N., Quinteros E., Roberts M. Surface Modification for the Collection and Identification of Fingerprints and Colorimetric Detection of Urea Nitrate // Journal of Forensic Science. 2015. Vol. 60. Iss. 1. P. 193–196.
[63] См. подробнее: Cross S. N., Quinteros E., Roberts M. Surface Modification for the Collection and Identification of Fingerprints and Colorimetric Detection of Urea Nitrate // Journal of Forensic Science. 2015. Vol. 60. Iss. 1. P. 193–196.
[64] См. подробнее: Cross S. N., Quinteros E., Roberts M. Surface Modification for the Collection and Identification of Fingerprints and Colorimetric Detection of Urea Nitrate // Journal of Forensic Science. 2015. Vol. 60. Iss. 1. P. 193–196.
[60] См.: Almog J., Klein A., Tamiri T., Shloosh Y., Abramovich-Bar S. A field diagnostic test for the improvised explosive urea nitrate // Forensic Science International. 2005. Vol. 50. Iss. 3. P. 582–586; Almog J., Rozin R. Colorimetric detection of urea nitrate: the missing link // Forensic Science International. 2011. Vol. 208. Iss. 1–3. P. 25–28
[58] См. подробнее: Cross S. N., Quinteros E., Roberts M. Surface Modification for the Collection and Identification of Fingerprints and Colorimetric Detection of Urea Nitrate // Journal of Forensic Science. 2015. Vol. 60. Iss. 1. P. 193–196.
[59] См.: Almog J., Klein A., Tamiri T., Shloosh Y., Abramovich-Bar S. A field diagnostic test for the improvised explosive urea nitrate // Forensic Science International. 2005. Vol. 50. Iss. 3. P. 582–586; Almog J., Rozin R. Colorimetric detection of urea nitrate: the missing link // Forensic Science International. 2011. Vol. 208. Iss. 1–3. P. 25–28
[54] См.: Hazarika P., Jickells S. M., Wolff K., Russell D. A. Multiplexed detection of metabolites of narcotic drugs from a single latent fingermark // Analytical Chemistry. 2010. Vol. 82. Iss. 22. P. 9150–9154; Leggett R., Lee-Smith E. E., Jickells S. M., Russell D. A. “Intelligent” fingerprinting: simultaneous identification of drug metabolites and individuals using antibody-functionalized nanoparticles // Angewandte Chemie International Edition. Vol. 46. Iss. 22. 2007. P. 4100–4103; Nambayah M., Quickenden T. I. A quantitative assessment of chemical techniques for detecting traces of explosives at counter-terrorist portals // Talanta 2004. Vol. 63. P. 461–467; Tang HW, Lu W, Che CM, Ng KM. Gold nanoparticles and imaging mass spectrometry: double imaging of latent fingerprints // Analytical Chemistry. 2010. Vol. 82. Iss. 5. P. 1589–1593.
[55] См.: Bradshaw R., Rao W., Wolstenholme R., Clench M. R., Bleay S., Francese S. Separation of overlapping fingermarks by matrix-assisted laser desorption ionization mass spectrometry imaging // Forensic Science International. 2012. Vol. 222. Iss. 1–3. P. 318–326; Szynkowska M. I., Czerski K., Rogowski J., Paryjczak T., Parczewski A. Detection of exogenous contaminants of fingerprints using ToF-SIMS // Surface Science Applications in Forensic Analysis. 2010. Vol. 42. Iss. 5. P. 393–397.
[56] См.: Cross S. N., Quinteros E., Roberts M. Surface Modification for the Collection and Identification of Fingerprints and Colorimetric Detection of Urea Nitrate // Journal of Forensic Science. 2015. Vol. 60. Iss. 1. P. 193–196.
[57] См.: Almog J., Klein A., Tamiri T., Shloosh Y., Abramovich-Bar S. A field diagnostic test for the improvised explosive urea nitrate // Forensic Science International. 2005. Vol. 50. Iss. 3. P. 582–586; Almog J., Rozin R. Colorimetric detection of urea nitrate: the missing link // Forensic Science International. 2011. Vol. 208. Iss. 1–3. P. 25–28.
[65] См.: Leggett R., Lee-Smith E. E., Jickells S. M., Russell D. A. “Intelligent” fingerprinting: simultaneous identification of drug metabolites and individuals using antibody-functionalized nanoparticles // Angewandte Chemie International Edition. Vol. 46. Iss. 22. 2007. P. 4100–4103; Szynkowska M. I., Czerski K., Rogowski J., Paryjczak T., Parczewski A. Detection of exogenous contaminants of fingerprints using ToF-SIMS // Surface Science Applications in Forensic Analysis. 2010. Vol. 42. Iss. 5. P. 393–397; West M. J., Went M. J. The spectroscopic detection of exogenous material in fingerprints after development with powders and recovery with adhesive lifters // Forensic Science International. 2008. Vol. 174. Iss. 1. P. 1–5; Bradshaw R., Rao W., Wolstenholme R., Clench M. R., Bleay S., Francese S. Separation of overlapping fingermarks by matrix-assisted laser desorption ionization mass spectrometry imaging // Forensic Science International. 2012. Vol. 222. Iss. 1–3. P. 318–326; Day J. S., Edwards H. G.M., Dobrowski S. A., Voice A. M. The detection of drugs of abuse in fingerprints using Raman spectroscopy II: cyanoacrylate-fumed fingerprints // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2004. Vol. 60. Iss. 8–9. P. 1725–1730; Hazarika P., Jickells S. M., Wolff K., Russell D. A. Imaging of latent fingerprints through the detection of drugs and metabolites // Analytical Chemistry. 2008. Vol. 47. Iss. 52. P. 10167–10170; Hazarika P., Jickells S. M., Russell D. A. Rapid detection of drug metabolites in latent fingermarks // Analyst. 2009. Vol. 134. Iss. 1. P. 93–96.
[66] См.: Day J. S., Edwards H. G.M., Dobrowski S. A., Voice A. M. The detection of drugs of abuse in fingerprints using Raman spectroscopy II: cyanoacrylate-fumed fingerprints // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2004. Vol. 60. Iss. 8–9. P. 1725–1730; Sodhi G. S.J., Kaur J. Powder method for detecting latent fingerprints: a review // Forensic Science International. 2001. Vol. 120. Iss. 3. P. 172–176.
§ 1.5. Оценка эффективности применения масс-спектрометрии с использованием вторичных ионов С60 для химического анализа и обработки изображений отпечатков пальцев рук
В экспертной практике США химический анализ отпечатков пальцев рук применяется относительно длительное время. Исследователи отмечают, что экспертно-криминалистической практике требуются методы, способствующие определению химического состава компонентов ПЖВ отпечатков, расширению методов исследования процессов деградации отпечатков, обнаружения в них экзогенных компонентов, например, взрывчатых веществ, наркотических средств67. По мнению американских экспертов, применение новых методик необходимо для выявления особенностей химического состава отпечатков. Определение таких особенностей дает дополнительную диагностическую информацию о личности68. Методы, часто используемые в экспертной практике для химического анализа отпечатков: масс-спектрометрия в сочетании с газовой хроматографией (технология ГХ/МС), способствуют идентификации большого количества соединений, присутствующих в составе ПЖВ69. Все они основываются на необходимости растворения большей части вещества, что исключает последующее визуальное микроскопическое исследование отпечатков и сохранение их структуры70.
В анализируемых нами исследованиях применяются методы пространственно распределенной масс-спектрометрии для анализа отпечатков с использованием химической сигнатуры эндогенных или экзогенных материалов. В частности, масс-спектрометрия десорбционной ионизации электроспреем (DESI-MS)71, масс-спектрометрия десорбционной ионизации матрицы с помощью лазера (MALDI-MS)72, масс-спектрометрия с ионизацией вторичными ионами (secondary ion mass spectrometry — SIMS)73. Все эти методы способствовали получению химической информации и изображения отпечатков.
Масс-спектрометрия с ионизацией вторичными ионами (SIMS) является высоковакуумным и высокочувствительным методом, способствующим отображению поверхности. Метод основывается на применении энергии пучка первичных ионов, ускоренных в направлении образца. Взаимодействие первичного пучка с образцом приводит к десорбции или распылению характерных вторичных ионов из этого образца, которые после экстрагируются и анализируются с помощью масс-анализатора. Первичный пучок ионов может состоять из разного вида частиц, в том числе таких, как моноатомный цезий и кислород или новых многоатомных кластерных ионных источников, в частности, фуллерен и гексафторид серы. Для органических аналитов кластерные источники могут обеспечить эффективность ионизации и выход вторичных ионов на высшие порядки, чем одноатомные источники74. Кроме того, накопление повреждений, вызванных первичным лучом, может быть значительно уменьшено с использованием кластерных «снарядов»75. Уменьшение ущерба связано с диссоциацией ионной группы при соударении с поверхностью, что приводит к разделению энергии среди составляющих кластера. Таким образом, средняя энергия, приходящаяся на один ударяющий атом в кластерном источнике значительно ниже, чем в традиционном одноатомном первичном пучке, обеспечивает уменьшение глубины проникновения атомов кластера и улучшенную локализацию энергии пучка в приповерхностной области образца.
Существует несколько преимуществ SIMS для применения в судебно-экспертном анализе отпечатков. Во-первых, метод обеспечивает низкие пределы обнаружения. Низкие пределы объясняются более высоким пространственным разрешением, чем у других методов визуализации, например, DESI-MS76. Во-вторых, по предположению исследователей доказательственное значение отпечатков сохраняется до тех пор, пока минимальные размеры образца превышают несколько монослоев, уничтожаемых (в силу экспертной необходимости) во время исследования. Эта технология имеет отличия от других, в частности, DESI-MS, где гребни отпечатка растворяются при распылении растворителя. Для применения SIMS необходимо учитывать наличие потери летучих компонентов в сверхвысоком вакууме.
Изображения отпечатка также могут быть получены с помощью характерных молекулярных ионов экзогенных или эндогенных компонентов. SIMS способствует выявлению органических и неорганических компонентов, дает возможность увеличивать глубину гребней профилей отпечатков и исследовать химический состав гребня отпечатка. Изучение по всей глубине гребней способствует дифференциации поверхностных изменений состава гребней от изменений в толще гребня отпечатка. В анализируемой работе оценивается возможность применения метода С60 совместно с масс-спектрометрией вторичных ионов (SIMS — secondary ion mass spectrometry ) для химического анализа отпечатков в процессе лабораторных экспертных исследований.
Во всех экспериментах использовался прибор Cameca IMS 4f SIMS (компания Cameca Instruments, район Парижа Genneviller Cedex, Франция)77, снабженный источником первичных ионов Ionoptika С60+ (компания Ionoptika Ltd., графство Hampshire, Великобритания). Первичные ионы C60+ получены путем нагревания порошкообразного фуллерена до состояния пара с последующей ионизацией ударом электронов, испускаемых вольфрамовой нитью78. Ионы С60+ отбирались с помощью фильтра Вейна (Wein filter) и ускорялись до 10 кэВ. Для всех масс-спектральных анализов использовался первичный ионный ток равный приблизительно 5,0×10-12 А. Сфокусированный луч диаметром около 25 мкм растрировался на площадь размером 500 × 500 мкм. В условиях масс-спектрального анализа на один квадратный сантиметр доставлялась доза ионов равная 4×1010. Ускоряющее напряжение вторичных ионов для режима работы с положительными ионами составляло 1,12 кВ, что позволило анализировать с помощью вторичных ионов с диапазоном масс, равным 0–1200 m/z. Однако установленный диапазон 0–800 m/z выбран в связи с отсутствием достаточной интенсивности сигнала в области, превышающей 800 m/z. Для масс-спектрального анализа с помощью отрицательных ионов использовалось напряжение ускорения вторичных ионов равное 1,12 кВ с напряжением постускорения величиной +10 кВ, приложенным к электронному умножителю. Для отрицательного режима в связи с отсутствием сигнала в области > 600 m/z, выбран диапазон масс равный 0–600 m/z. Для получения каждого масс-спектра использовалось 1800–2400 точек данных в зависимости от диапазона масс, с временем интегрирования 0,1 секунды на точку сканирования. Масс-спектры получены с использованием растра размером 500 × 500 мкм с областью изображения 150 × 150 мкм. Масс-спектры получены с помощью электронного умножителя с постускорительным напряжением величиной 10 кВ в целях минимизации потерь эффективности детектора из-за более низких вторичных ускоряющих напряжений.
Для каждого исследуемого отпечатка отобрали пять масс-спектров, соответствующих положительным вторичным ионам и пять, соответствующих отрицательным. Масс-спектры собирали из разных областей отпечатка для нивелирования изменений в химическом составе, связанных с повреждениями, вызванными первичным пучком при применении повторяющихся исследований. Экспертный анализ отпечатков завершился по истечении четырех часов после осаждения. Указанное действие выполнялось для минимизации изменений состава ПЖВ, обусловленных старением отпечатков. Для корректировки ежедневных инструментальных изменений, обусловленных различиями в фокусировке вторичных ионов и изменениями стабильности потока первичного пучка, масс-спектры нормализовались по полному количеству ионов отдельных спектров. Изображения получены в режиме их формирования с помощью микролуча путем растрирования пучка первичных ионов на площадь 500 × 500 мкм с использованием для обнаружения вторичных ионов электронного умножителя с временем интегрирования 1–20 секунд на одно изображение в зависимости от интенсивности сигнала аналита.
В целях создания полного изображения отпечатка собрано 40×40 плотно упакованных массивов отдельных изображений с использованием автоматизированного поэтапного управления, с отдельными шагами по осям × и y равными 500 мкм. После отдельные изображения были вшиты в строки и выровнены вручную с использованием программного обеспечения ImagePro (компания Media Cybernetics, штат Пенсильвания, США). Глубинные профили отпечатков получены путем растрирования луча на площади 500 × 500 мкм с областью изображения 250 × 250 мкм и использованием апертуры диаметром 60 мкм для минимизации граничных эффектов каверны.
Пробы и массы субстрата контролировались детектором электронного умножителя с интегрированием сигнала равным 1 секунде на массу. Интенсивность ионов контролировалась до тех пор, пока сигналы вторичных ионов всех разновидностей не становились постоянными в течение как минимум 30 секунд. Для профилей глубин использовался ток первичных ионов величиною 3×10-10 А, поставлявший ионную дозу равную 4×1012 ионов/см2 для профиля глубины 500 с. Для сравнения химических изображений с фактическим отпечатком оптические изображения получали с помощью микроскопа Zeiss Discovery.V9 SteREO с одним объективом. Использовалось автоматизированное выполнение этапов для пошагового формирования изображения. Причем сшивание участков осуществлялось с помощью программного обеспечения ImagePro.
В процессе подготовки образца все отпечатки и чистые соединения аналита переносились на тонкие круглые кремниевые пластины диаметром 2,54 см, предварительно очищенные этанолом. Кремниевые пластины были выбраны потому, что они обеспечивают оптимальные (по проводимости и по плоскостности) условия для использования SIMS. В случае выбора пластин из других материалов могла потребоваться нейтрализации заряда с помощью электронной бомбардировки.
В общей сложности тридцать пять образцов отпечатков получено от пяти доноров в Университете штата Мэриленд без идентификационной информации. Перед отображением доноры прикасались пальцем к переносице для перенесения компонентов ПЖВ. При этом, никакого особого ухода за руками, их мытья не выполнялось. Указанное действие совершалось для того, чтобы появилась возможность проведения одновременного анализа эккрина и сальных компонентов. Все отпечатки взяты от правого указательного пальца донора. Отпечатки получены от всех доноров в один день (и разные дни) для исследования процесса изменчивости компонентов состава ПЖВ. В целях обеспечения качественной диагностики, додекановая, тридекановая, тетрадекановая, пентадекановая, пальмитиновая, гептадекановая, стеариновая, арахидиновая кислоты, холестерин, сквален, диметилдиоктадциламмонийбромид, глицин и мочевина приобретены у компании Sigma-Aldrich (город Сент-Луис, штат Миссури, США) с чистотой 95% или выше.
Для помещения соединений на кремниевые пластины около 0,1 г аналита растворяли в 5 мл н-гептана или метанола с помощью ультразвука. Далее на кремниевую пластину осаждали аликвоту (20 мкл) раствора и перед началом анализа выпаривали растворитель, что обеспечило приблизительно 2 мг образца, распределенного по пластине. Для последующего анализа отпечатков после их отображения они были запылены с использованием рекомендованных процедур. Для визуализации отпечатков использовались дактилоскопические порошки Sirchie (город Янгсвилл, штат Северная Каролина, США). В частности, «Sirchie Hi-Fi Volcano Latent Print Powder» (порошок черного цвета), «Sirchie Magnetic Latent Print Powder» и «Sirchie Fluorescent Invisible Detection Powder» (порошок бледно-желтого цвета).
Идентификация составляющих компонентов отпечатков. Первая цель исследования состояла в установлении компонентов состава ПЖВ, которые можно выявить с помощью С60+ SIMS. Некоторые из основных компонентов зарегистрированы с использованием нескольких аналитических методов, отраженных в табл. 179. С использованием SIMS идентифицирован ряд сальных компонентов и эккринов. Идентификация подтверждена сравнением спектра отпечатка со спектром чистых соединений. Репрезентативный масс-спектр отпечатков для положительных ионов показан на рис. 1.
Таблица 1
Общие классы компонентов эккринов и сальных выделений отпечатков пальцев80
| Эккрины | Сальные выделения |
| Неорганические соли | Свободные жирные кислоты |
| Аминокислоты | Холестерин |
| Белки | Эфиры холестерина |
| Глюкоза | Сквален |
| Лактат | Восковые эфиры |
| Мочевина | Глицериды |
| Но- мер пи- ка |
Номи- наль- ная мас- са |
Соответс- твие |
Но- мер пи- ка |
Номи- наль- ная мас- са |
Соответствие |
| 1 | 23 | Натрий Na+ | 9 | 257 | Пальмитиновая кислота [M+H] + |
| 2 | 28 | Кремний Si+ | 10 | 285 | Стеариновая кислота [M+H] + |
| 3 | 39 | Калий K+ | 11 | 313 | Арахидиновая кислота [M+H] + |
| 4 | 40 | Кальций Ca+ | 12 | 369 | Холестерин [М-ОН] + |
| 5 | 201 | Додекановая кислота [M+H]+ | 13 | 387 | Холестерин [M+H]+ |
| 6 | 215 | Тридекановая кислота [M+H]+ | 14 | 411 | Сквален [M+H] + |
| 7 | 229 | Тетраде- кановая кислота [М+Н] + |
15 | 551 | Диметилдиока- дециламмоний [M]+ |
| 8 | 243 | Пентаде- кановая кислота [M+H] + |
16 | 500–650 | Диглицериды |
Рис. 1. Репрезентативный масс-спектр химического состава отпечатка, собранного в режиме использования положительных ионов с номинальным положением определяемых комплексов. Диглицериды не идентифицированы при сравнении со стандартами, и данные о них основаны на изучении литературы. Масс-спектр изображен в соответствии с относительной интенсивностью общего количества ионов81
Среди идентифицируемых компонентов в «положительном» спектре превалирующими оказались свободные жирные кислоты, содержащие 12–20 атомов углерода. Сквален и холестерин обнаруживаются, но сигнал от этих соединений быстро снижается после их отображения по истечении времени, что, вероятно, объясняется сочетанием высокой степени их испаряемости в вакууме и выветриванием82. Жирные кислоты и сквален образуют ионы [M+H]+. Холестерин продуцирует незначительный [M+H]+ и основной пики [M-OH]+. Указанные пиковые распределения подтверждены методом ToF-SIMS, обеспечившим более высокое разрешение по массе, чем полученное с использованием С60 SIMS (данные не приведены).
В экспериментах с положительным ионом присутствует экзогенное соединение диметилдиоктадециламмоний (m/z 551), найденное почти во всех отпечатках. Этот комплекс обычно содержится в мылах и лосьонах для рук и, как ранее сообщалось, он найден в отпечатках83. Сигнал от кремниевой подложки также обнаруживается. Пики в более высоком диапазоне масс (500–700 m/z), по всей видимости, представляют собой несколько различных диглицеридов, являющихся основными компонентами сальных выделений84. Из-за высокой вариабильности глицеридной композиции попытки идентификации конкретных диглицеридов с использованием С60+ SIMS не предпринимались. Идентификация названных соединений основывалась на научных источниках. В спектре отрицательных ионов, показанном на рис. 2, идентифицировано меньше соединений, представляющих интерес по сравнению со спектром положительных ионов. По аналогии со спектром положительных ионов, спектр отрицательных, показывает определенное количество свободных жирных кислот и некоторые анионы, присутствующие в выделениях эккринных желез.
Свободные жирные кислоты, присутствующие в качестве иона [M-H]-, имеют более сильный сигнал в режиме отрицательных ионов, чем в режиме положительных. Глицин, аминокислота, идентифицированы в этом режиме, в отличие от положительного режима, где повышенный фон в области 80–120 m/z возможно препятствовал проведению идентификации. Еще одна группа соединений, которые SIMS может обнаружить в положительном и отрицательном режимах, представляет собой неорганические соли эккринов. В процессе исследования идентифицировано несколько катионов и анионов.
Анализируемый метод способствует получению дополнительной информации, которую другие способы, например, GC-MS не могут предоставить. Из пяти доноров, чьи отпечатки анализировались, качественная меж- и внутричеловеческая изменчивость была минимальной. Заметные различия в масс-спектрах включали наличие или отсутствие холестерина и сквалена, а в одном случае отсутствие диметилдиоктадециламмония. Кроме того, хотя свободные жирные кислоты обнаруживаются в каждом отпечатке, при сравнении их относительная интенсивность варьируется между донорами и внутри разных отпечатков одного донора. В экспериментах использовались пустые кремниевые пластины, чтобы гарантировать, что обнаруженные и идентифицированные пики связаны не с фоном подложки или с кластерными ионами, образованными из материала подложки. Поскольку это метод микроанализа, а не метод анализа больших объемов, количественные измерения не производились.
Влияние методов визуализации отпечатков на процесс проведения идентификационных исследований. Чтобы установить степень влияния методов визуализации отпечатков на результаты анализа отпечатков, использовались три дактилоскопических порошка компании Sirchie (США): а) черный порошок (Volcano Latent Print Powder); б) флуоресцентный порошок (Fluorescent Invisible Detection Powder); в) магнитный порошок (Magnetic Latent Print Powder). Масс-спектры отпечатков сравнивали до и после применения порошка. Обнаружено, что во всех случаях, когда анализ отпечатка проводился до и после визуализации, масс-спектр оставался в значительной степени неизменным, за исключением увеличения относительной интенсивности сигнала в диапазоне 0–150 m/z. Примеры различий в масс-спектрах показаны на рис. 3.
| Но- мер пи- ка |
Номи- наль- ная мас- са |
Соответ- ствие |
Но- мер пи- ка |
Номи- наль- ная мас- са |
Соответствие |
| 1 | 35&37 | Хлорид Cl - | 7 | 199 | Додекановая кислота [M-H] - |
| 2 | 59 | Мочевина [M-H] - | 8 | 227 | Тетрадекановая кислота [М-Н] - |
| 3 | 74 | Глицин [M-H] - | 9 | 241 | Пентадекановая кислота [M-H] - |
| 4 | 80 | Бромид Br - | 10 | 255 | Пальмитиновая кислота [M-H] - |
| 5 | 95 | Фосфат P04 - | 11 | 269 | Гептадекановая кислота [M-H] - |
| 6 | 96 | Сульфат S04 - | 12 | 283 | Стеариновая кислота [M-H] - |
Рис. 2. Репрезентативный масс-спектр химического состава отпечатка, собранного в режиме отрицательных ионов. Указано номинальное положение некоторых идентифицированных компонентов85
Рис. 3. Влияние черного порошка (BP), флуоресцентного порошка (FP) и магнитного порошка (MP) на SIMS масс-спектр отрицательных ионов86
Во всех случаях фон от использования порошков был минимальным в просмотренном диапазоне масс 150–600 m/z. В то время как все компоненты, обнаруженные в отпечатке, присутствовали до и после применения визуализации, во всех случаях наблюдалось изменение интенсивности сигнала. В диапазоне масс, идущем после 150 m/z, интенсивность сигнала была одинаковой до и после применения порошков. Показано, что интенсивность в диапазоне, лежащем ниже 150 m/z, возрастает во всех случаях, что может быть связано с увеличением в данной области масс фона, вызванного порошками. Однако даже при этих изменениях в масс-спектрах все изначально обнаруженные соединения идентифицировались. Установленное постоянство в обнаружении компонентов отпечатков свидетельствует, что метод C60+ SIMS может использоваться для химического анализа отпечатков до и после осуществления визуализации отпечатков, что делает его практичным и эффективным.
Отображение отпечатка пальца. Одним из важных преимуществ SIMS является возможность получать изображения с высоким пространственным разрешением химического состава образца в дополнение к масс-спектрам. Одновременное получение изображений и масс-спектров позволяет соотносить присутствие определенных аналитов с их конкретным местоположениям в отпечатке и выделять из фона. Возможность получения изображения химической сигнатуры отпечатка может использоваться и как способ получения высокого качества изображения слабо визуализируемых отпечатков и как метод, способствующий дифференциации перекрывающихся отпечатков или отпечатков, соединенных с другими веществами, например, чернила87.
Химические образцы могут быть полезны при определении местонахождения таких экзогенных материалов, как взрывчатые вещества, наркотики, что позволило бы произвести прецизионное извлечение их из отпечатка. Кроме того, такое специфичное изображение позволяет исследователям уменьшить влияние субстрата, вычитая его фоновый сигнал или сравнивая изображение образца с фоном.
Получение изображения отпечатка с помощью SIMS производилось с предварительным применением метода ToF-SIMS88, однако в предыдущих исследованиях не использовался источник C60+ или оборудование магнитного сектора SIMS. Изображение отпечатка с помощью метода C60+ SIMS может быть сформировано с использованием ряда различных сигналов вторичных ионов в случае, когда время, необходимое для его получения, зависит от интенсивности сигнала. Анализы с сильными сигналами, такими как те, что дает натрий и калий в положительном режиме или жирные кислоты в отрицательном, могут быть отображены со временем интегрирования равным 1 секунде на одно изображение.
Соединения с более слабыми сигналами вторичных ионов потребуют 10–20 секунд времени интегрирования для одного изображения. Для получения изображения всего отпечатка требуется сшивание сотен отдельных изображений. В режиме отрицательных ионов с относительно сильным сигналом пальмитиновой кислоты для получения полного изображения отпечатка требуется около часа. Чтобы определить, есть ли корреляция изображений SIMS с гребнями или впадинами отпечатков, мозаика из 5×5 изображений для отрицательного иона пальмитиновой кислоты (m/z 255) получена с помощью трехсекундного интегрирования.
Пальмитиновая кислота выбрана потому, что названное органическое соединение обеспечило наибольшую интенсивность и наименьшее время интеграции. Кроме того, это самая распространенная насыщенная жирная кислота в отпечатках89. Как только изображение пальмитиновой кислоты было скомпилировано, оно сравнивалось со стереомикроскопическим изображением в отраженном свете той же области (рис. 4). Из полученного изображения видно, что распределение ионов пальмитиновой кислоты коррелирует с гребнями отпечатков.
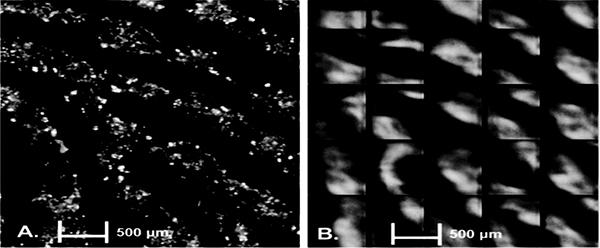
Рис. 4. Определение хребтов и впадин отпечатков. Изображение (A) получено с помощью микроскопа Zeiss Discovery.V9 SteREO с 1 объективом. Полученное изображение сравнивалось с изображением SIMS (B), созданным по сигналам ионов пальмитиновой кислоты [M-H] — (255 m/z), чтобы определить наличие пальмитиновой кислоты в гребнях нового отпечатка90
После обнаружения корреляции исследователи отобразили весь отпечаток. На рис. 5 показано изображение, собранное из сигналов отрицательных ионов пальмитиновой кислоты, с использованием SIMS, а также оптическое изображение с тем же отпечатком. В данном случае каждое изображение было интегрировано в течение секунды со времени предварительного распыления равного секунде. Подобные изображения получены с использованием натрия, калия, хлорида, миристиновой и стеариновой кислот. Из-за требования необходимости увеличения времени на сбор данных в описанном методе, оптическая микроскопия по-прежнему имеет преимущества при проведении стандартной визуализации отпечатков, когда не требуется проведения химического анализа. В случаях, когда требуется информация о наличии химических соединений в отпечатках или корреляции их распределения с его структурой или фоном, технология получения изображений с помощью масс-спектрометрии, в частности, SIMS имеет существенные преимущества. Кроме того, применение визуализации изображений с помощью SIMS или другой методики способствует установлению наличия наркотических средств, взрывчатых веществ в составе ПЖВ отпечатков.
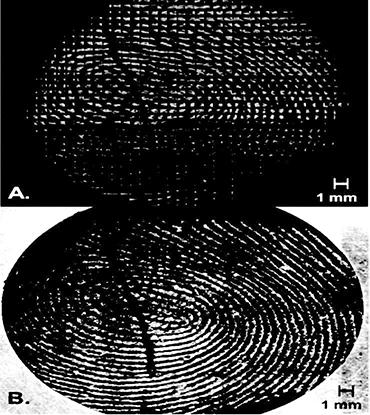
Рис. 5. Сравнение изображения отпечатка методом SIMS (A) и оптического изображения (B). Отдельные изображения SIMS собирались в отрицательном режиме с использованием сигнала от иона пальмитиновой кислоты. (A) Период предварительного распыления составлял секунду перед каждым интегрированием. Оптическое изображение получено с помощью микроскопа Zeiss Discovery.V9 SteREO
Профилирование впадин. Молекулярное SIMS профилирование впадин с использованием кластерной ионной бомбардировки C60+ является новым методом исследования изменений химического состава органического образца по глубине гребня. Метод способствует определению не только поверхностных, но и объемных эффектов, которые могут создаваться, например, таким экзогенным аналитом, как частицы взрывчатых веществ, наркотических средств, расположенные на поверхности гребня отпечатка или внедрившиеся в его гребень. Такая идентификация может дать информацию относительно механизма осаждения, позволяющую установить был ли аналит изначально на пальце, или он обнаружен вследствие последующего загрязнения. Первоначально было неясно, возможно ли получение молекулярного профиля по глубине гребней отпечатка из-за их неоднородности и различий в толщине. Однако рис. 6 показывает, что возможность получения профиля имеется.
Установлено, что сигнал жирных кислот уменьшается по мере того, как гребень профилируется, тогда как сигнал кремниевого фона увеличивается по интенсивности, что свидетельствует о постепенном разрушении папиллярного гребня. Момент, когда выравниваются сигналы от кремния и жирных кислот и момент, когда целостность гребня полностью отсутствует. В настоящее время этот метод невозможно использовать совместно с существующими способами создания давления.
Рис. 6. Профиль глубины гребня отпечатка для нескольких жирных кислот в сравнении с кремниевой подложкой (слева). Масс-спектры жирных кислот в трех временных точках во время профилирования глубины (справа на рисунке). Представленные масс-спектры показаны перед профилированием глубины (A), в начале снижения сигнала жирной кислоты (B) и после профилирования глубины (C). Профиль глубины и масс-спектр получены в режиме отрицательных ионов91
В исследовании показано, что C60+ SIMS является пригодным методом для проведения химического анализа отпечатков в процессе экспертного исследования. С помощью SIMS возможно обнаружить ряд соединений, которые обычно встречаются в ПЖВ отпечатков, в том числе эккрины и сальные компоненты. Дальнейшие исследования должны способствовать выявлению дополнительных компонентов эккрина и определению способов идентификации глицеридов. Авторы полагают, что некоторые соединения, например, ненасыщенные жирные кислоты с короткой цепью, и молочную кислоту из-за их летучести в условиях вакуума невозможно обнаружить. Кроме того, химический состав отпечатков, по-видимому, в значительной степени не подвержен влиянию технологий визуализации, включая применение черного, флуоресцентного или магнитного порошков, которые, должны чаще использоваться, поскольку эти вещества не вступают в химическую реакцию с ПЖВ отпечатка.
С применением SIMS возможно создание химических образов отпечатков и получение дополнительной информации о личности. Получение изображений SIMS при анализе отпечатков может быть эффективным в силу нескольких обстоятельств. Например, при необходимости обнаружения в отпечатках взрывчатых веществ, наркотиков или других компонентов, не поддающихся оптическому обнаружению с помощью микроскопа. Использование изображений SIMS способствует исследованию слабо проявляющихся отпечатков. Кроме того, применение движущегося SIMS дает возможность получить профиль углублений отпечатка, что способствует исследованию изменений в химическом составе по всему папиллярному гребню. Профилирование глубины гребней может способствовать определению местонахождения экзогенных химикатов в нижних или верхних слоях отпечатков, что позволяет установить хронологию проверяемых событий.
По сравнению с другими методами масс-спектрометрии, используемыми для получения химической информации из отпечатков, SIMS дает возможность анализа отпечатка без подготовки образца, способствуя исследованию органических и неорганических компонентов. После применения SIMS структура отпечатка остается практически неизменной и может использоваться в последующем биометрическом анализе или сравнении скрытых отпечатков. Одним из потенциально возможных ограничений рассматриваемого метода является его неспособность к обнаружению всех прогнозируемых веществ в отпечатке. Хотя маловероятно, что один метод будет эффективен для обнаружения всех компонентов ПЖВ. В отдельных работах высказывается предположение, что дополнительную информацию могут предоставить дериватизация отпечатков или использование методов масс-спектрометрии при давлении внешней среды.
В настоящее время американские дактилоскописты проверяют эффективность некоторых методов ионизации окружающей среды для идентификации компонентов ПЖВ. Нерешенной проблемой остается потенциальная потеря летучих компонентов, которая может быть устранена применением охлажденной стадии образца или вышеупомянутых методов, работающих при давлении окружающей среды. Однако, как отмечают зарубежные специалисты, даже с этими ограничениями применение C60+ SIMS является эффективным методом химического анализа для визуализации скрытых отпечатков пальцев.
[72] См.: Wolstenholme R., Bradshaw R., Clench M. R., Francese S. Study of latent fin-germarks by matrix-assisted laser desorption/ionisation mass spectrometry imaging of endogenous lipids // Rapid Communications in Mass Spectrometry. 2009. Vol. 23. Iss. 19. P. 3031–3039.
[73] См.: Bright N. J., Webb R. P., Bleay S., Hinder S., Ward N. I., Watts J. F., Kirkby K. J., Bailey M. J. Determination of the deposition order of overlapping latent fingerprints and inks using secondary ion mass spectrometry // Analytical Chemistry. 2012. Vol. 84. Iss. 9. P. 4083–4087; Sun S., Szakal C., Smiley E., Postawa Z., Wucher A., Garrison B., Winograd N. Sputtering of Ag under C60+ and Ga+ projectile bombardment // Applied Surface Science. 2004. Vol. 231–232. P. 64–67; Szynkowska M. I., Czerski K., Grams J., Paryjczak T., Parczewski A. Preliminary studies using imaging mass spectrometry TOF-SIMS in detection and analysis of fingerprints // Imaging Science Journal. 2007. Vol. 55. Iss. 3. P. 180–187.
[74] См.: Sun S., Szakal C., Smiley E., Postawa Z., Wucher A., Garrison B., Winograd N. Sputtering of Ag under C60+ and Ga+ projectile bombardment // Applied Surface Science. 2004. Vol. 231–232. P. 64–67.
[75] См.: Winograd N. The magic of cluster SIMS // Analytical Chemistry. 2005. Vol. 77. Iss. 7. P. 142A–149A.
[70] См.: Lee H. C., Gaensslen R. E. Advances in Fingerprint Technology, 2nd ed., CRC Press, Boca Raton. 2001. Р. 63–104.
[71] См.: Hinder S. J., Watts J. F. SIMS fingerprint analysis on organic substrates // Sur-face and Interface Analysis. 2010. Vol. 42. Iss. 6–7. P. 826–829.
[69] См.: Archer N. E., Charles Y., Elliott J. A., Jickells S. Changes in the lipid composition of latent fingerprint residue with time after deposition on a surface // Forensic Science International. 2005. Vol. 154. Iss. 2–3. Р. 224–239; Croxton R. S., Baron M. G., Butler D., Kent T., Sears V. G. Variation in amino acid and lipid composition of latent fingerprints // Forensic Science International. 2010. Vol. 199. Iss. 1–3. P. 93–102; De Paoli G., Lewis Sr. S. A., Schuette E. L., Lewis L. A., Connatser R. M., Farkas T. Photo-and thermal-degradation studies of select eccrine fingerprint constituents // Journal of Forensic Science 2010. Vol. 55. P. 962–969; Ifa D. R., Manicke N. E., Dill A. L., Cooks R. G. Latent fingerprint chemical imaging by mass spectrometry // Science. 2008. Vol. 321. Iss. 5890. P. 805; Lee H. C., Gaensslen R. E. Advances in Fingerprint Technology, 2nd ed., CRC Press, Boca Raton. 2001. Р. 63–104; Ricci C., Phiriyavityopas P., Curum N., Chan K. L.A., Jickells S., Kazarian S. G. Chemical imaging of latent fingerprint residues // Applied Spectroscopy. 2007. Vol. 61. P. 514–522.
[67] См.: Rowell F., Seviour J., Lim A. Y., Elumbaring-Salazar C. G., Loke J., Ma J. Detection of nitro-organic and peroxide explosives in latent fingermarks by DART- and SALDITOF-mass spectrometry // Forensic Science International. 2012. Vol. 221. P. 84–91; Sun S., Szakal C., Smiley E., Postawa Z., Wucher A., Garrison B., Winograd N. Sputtering of Ag under C60+ and Ga+ projectile bombardment // Applied Surface Science. 2004. Vol. 231–232. P. 64–67.
[68] См.: Buchanan M. V., Asano K., Bohanon A. Chemical characterization of fingerprints from adults and children in: Forensic Evidence Analysis and Crime Scene Investigation, SPIE (International Society for Optical Engineering). 1997. Vol. 2941 Р. 89–95; Mong G. M., Petersen C. E., Clauss T. R. W . Advanced Fingerprint Analysis Project. Final report — Fingerprint Constituents, Pacific Northwest National Laboratory Report, 1999 // URL: https://www.osti.gov/scitech/servlets/purl/14172 (дата обращения: 30.11.2017).
[83] См.: Manier M. L., Cornett D. S., Hachey D. L., Caprioli R. M. Identification of dimethyldioctadecylammonium ion (m/z 550.6) and related species (m/z 522.6, 494.6) as a source of contamination in mass spectrometry // Journal of The American Society for Mass Spectrometry. 2008. Vol. 19. Iss. 5. P. 666–670.
[84] См.: Emerson B., Gidden J., Lay J. O. Jr., Durham B. Laser desorption/ionization time-offlight mass spectrometry of triacylglycerols and other components in fingermark Samples // Journal Forensic Science. 2011. Vol. 56. Iss. 2. P. 381–389.
[85] См. подробнее: Sisco E., Demoranville L. T., Gillen G. Evaluation of C60 secondary ion mass spectrometry for the chemical analysis and imaging of fingerprints // Forensic Science International. Vol. 231. 2013. P. 263–269.
[86] См. подробнее: Sisco E., Demoranville L. T., Gillen G. Evaluation of C60 secondary ion mass spectrometry for the chemical analysis and imaging of fingerprints // Forensic Science International. Vol. 231. 2013. P. 263–269.
[80] См.: Lee H. C., Gaensslen R. E. Advances in Fingerprint Technology. 2nd ed. Boca Raton: CRC Press, 2001. Р. 63–104.
[81] См. подробнее: Sisco E., Demoranville L. T., Gillen G. Evaluation of C60 secondary ion mass spectrometry for the chemical analysis and imaging of fingerprints // Forensic Science International. Vol. 231. 2013. P. 263–269.
[82] См.: Archer N. E., Charles Y., Elliott J. A., Jickells S. Changes in the lipid composition of latent fingerprint residue with time after deposition on a surface // Forensic Science International. 2005. Vol. 154. Iss. 2–3. Р. 224–239; Mountfort K. A., Bronstein H., Archer N., Jickells S. M. Identification of oxidation products of squalene in solution and in latent fingerprints by ESI-MS and LC/APCIMS // Analytical Chemistry. 2007. Vol. 79. Iss. 7. P. 2650–2657.
[76] См.: Salter T. L., Green F. M., Gilmore I. S., Seah M. P., Stokes P. A comparison of SIMS and DESI and their complementarities // Surface and Interface Analysis. 2011. Vol. 43. Iss. 1–2. P. 294–297.
[77] В работе авторы делают оговорку о том, что конкретизация используемого в исследовании оборудования не означает наличие рекомендаций или одобрений Национального института стандартов и технологий (США), также не подразумевается, что использование определенных продуктов является обязательным для получения успешных результатов.
[78] См.: Fahey A. J., Gillen G., Chi P., Mahoney C. M. Performance of a C60+ ion source on a dynamic SIMS instrument // Applied Surface Science. 2006. Vol. 252. P. 7312–7314.
[79] См.: Girod A., Ramotowski R., Weyermann C. Composition of fingermark residue: a qualitative and quantitative review // Forensic Science International. 2012. Vol. 223. Iss. 1–3. P. 10–24; Lee H. C., Gaensslen R. E. Advances in Fingerprint Technology. 2nd ed. Boca Raton: CRC Press, 2001. Р. 63–104.
[90] См. подробнее: Sisco E., Demoranville L. T., Gillen G. Evaluation of C60 secondary ion mass spectrometry for the chemical analysis and imaging of fingerprints // Forensic Science International. Vol. 231. 2013. P. 263–269.
[91] См. подробнее: Sisco E., Demoranville L. T., Gillen G. Evaluation of C60 secondary ion mass spectrometry for the chemical analysis and imaging of fingerprints // Forensic Science International. Vol. 231. 2013. P. 263–269.
[87] См.: Bright N. J., Webb R. P., Bleay S., Hinder S., Ward N. I., Watts J. F., Kirkby K. J., Bailey M. J. Determination of the deposition order of overlapping latent fingerprints and inks using secondary ion mass spectrometry // Analytical Chemistry. 2012. Vol. 84. Iss. 9. P. 4083–4087; Hinder S. J., Watts J. F. SIMS fingerprint analysis on organic substrates // Surface and Interface Analysis. 2010. Vol. 42. Iss. 6–7. P. 826–829.
[88] См.: Szynkowska M. I., Czerski K., Rogowski J., Paryjczak T., Parczewski A. ToF-SIMS application in the visualization and analysis of fingerprints after contact with amphetamine drugs // Forensic Science International. 2009. Vol. 184. Iss. 1–3. Р. 24–26; Szynkowska M. I., Czerski K., Grams J., Paryjczak T., Parczewski A. Preliminary studies using imaging mass spectrometry TOF-SIMS in detection and analysis of fingerprints // Imaging Science Journal. 2007. Vol. 55. Iss. 3. P. 180–187.
[89] См.: Lee H. C., Gaensslen R. E. Advances in Fingerprint Technology. 2nd ed. Boca Raton: CRC Press, 2001. Р. 63–104.
§ 1.6. Сравнительный анализ способов регидратации, используемых в целях восстановления отпечатков пальцев рук мумифицированного трупа
Посмертные разложения мумифицированного трупа влекут высыхание и сморщенность его пальцев, снижая возможность визуализации папиллярных узоров для проведения идентификационного исследования. В анализируемом исследовании использованы пять специальных растворов для проведения регидратации пальцев рук мумифицированного трупа: гидроксид аммония, карбонат натрия, гидроксид калия, мочевина и теплая вода92. После использования названных растворов, применены определенные способы фиксации отпечатков: фотофиксация, использование чернильного рулона и пылезащитной ленты. Результаты исследований показывают, что обработка карбонатом натрия и гидроксидом аммония эффективна для восстановления деталей папиллярного узора пальца.
Настоящее исследование демонстрирует, что отпечатки пальцев, первоначально обработанные раствором мочевины, 1% раствором гидроксида калия и теплой водой, могли бы быть улучшены при последующей их обработки раствором карбоната натрия. Данное действие в большей степени способствовало получению подходящих для сопоставления деталей отпечатков. В ходе исследования сделан вывод, что наиболее оптимальна процедура регидратации фаланг пальцев мумифицированного трупа с помощью раствора карбоната натрия в течение 24 часов и последующего переноса визуализируемых отпечатков на поверхность пылезащитной ленты.
В соответствии с посмертными изменениями состояние пальцев у мумифицированного трупа может классифицироваться по следующим критериям: гибкость, жесткость, сухость, морщинистость. С учетом указанных состояний предопределяется выбор необходимой технологии визуализации и изъятия отпечатков, поскольку для разных степеней посмертных разложений предусмотрены различные способы получения отпечатков93. К числу основных проблем, с которыми сталкиваются исследователи в процессе получения отпечатков, относятся: чрезмерная сухость, наличие ямочек на фалангах пальцев, морщинистость и высыхание самих фаланг.
В литературе состояние пальцев рук мумифицированного трупа подразделяется на следующие стадии.
1. Ранняя мумификация. На данной стадии фаланги пальцев еще обладают визуализируемыми папиллярными линиями. Главная проблема заключается в жесткости, ямочках и морщинах, находящихся на пальцах. В таких случаях рекомендуются специализированные методы фото фиксации94. Глубокие ямочки на фалангах пальцев, влекущие трудности с их фотографированием могут быть устранены с помощью стоматологического литья или пластического моделирования95. Тем не менее это не устраняет проблему сопоставления отпечатков, поскольку литейные материалы сжимаются после дегидратации96.
2. Неполная или частичная мумификация. Характерна тем, что фаланги пальцев окрашиваются в темно-коричневый или черный цвет и на их основаниях присутствует исчисляемое количество видимых линий. Главная трудность в данном случае состоит в том, что линии становятся слишком сморщенными и размытыми из-за обезвоживания, что делает дальнейшее сопоставление отпечатков практически невозможным. Однако в ходе исследования обнаружено, что регидратация пальцев в кипящей воде способствует успешному восстановлению отпечатков97. Кроме того, оказался эффективен массаж фаланг пальцев под теплой водой в течение 15 минут98.
3. Полная мумификация. Данная стадия характеризуется тем, что фаланги пальцев становятся очень сухими, морщинистыми и хрупкими. Пальцы окрашиваются в темно-коричневый или черный цвет. На них отсутствуют борозды. Фотосъемка и применение литейных материалов полностью непригодны в такой ситуации. В этом случае исследователи предлагают использовать специальный раствор для регидратации, способствующий восстановлению гибкости и эластичности фаланг пальцев. Использовать данный метод необходимо до того, пока линии не станут достаточно заметными и контрастными. Восстановление мумифицированной ткани представляет интерес не только для судебной медицины, но и других наук, в частности, археологии99.
Авторы предлагают решение основной задачи по восстановлению отпечатков мумифицированного трупа с помощью регидратации, замечая, что предложенные методы будут полезны для других исследователей. Для эксперимента выбран труп, обнаруженный на заброшенной фабрике с обезображенными чертами лица. Посмертный интервал оценивался как минимум 2–3 месяца. Вследствие процессов разложения трупа некоторые пальцы оказались непригодными для исследования (рис. 1). После проведения судебно-медицинской экспертизы собрано пять объектов, пригодных для исследования: правый указательный палец, левый указательный, средний и мизинцы.

Рис. 1. Руки мумифицированного трупа100
Подготовка раствора для регидратации. С учетом опубликованных работ выбрано пять растворов для проведения регидратации:
- 1% раствор гидроксида калия101 и теплой водопроводной воды102;
- этанол;
- 25% раствор гидроксида аммония103;
- раствор карбоната натрия ([2,5 г карбонат натрия, 79 мл 95% этанола, 171 мл дистиллированной воды]104);
- раствор мочевины (5 г мочевины, 10 мл 95% этанола, 240 мл дистиллированной воды).
Очищенный гидроксид аммония, гидроксид калия и этанол приобретены у Shimakyu Chemical (Осака, Япония), порошок мочевины получен от Thermo Fisher Scientific (Виктория, Австралия), порошок карбоната натрия поставлялся компанией Yakuri Pure Chemicals (Киото, Япония). Все растворы в объеме 250 мл подготовлены в качестве рабочих реагентов.
Использовалось три метода снятия отпечатков пальцев:
- фотографирование;
- снятие отпечатков с помощью чернильного рулона;
- снятие отпечатков с помощью пылезащитной ленты.
Фотографический метод состоял в выполнении фотосъемки фаланг пальцев непосредственно после регидратации. Фотографирование выполнялось при дневном свете с помощью фотоаппарата CanonEOS 20D или 30D (Токио, Япония) с настройками камеры: экспозиция, автоматический баланс белого. Процедура снятия отпечатков с помощью чернильного рулона состояла в том, что на фаланги пальцев наносились специальные чернила, затем отпечатки переносились на белые бумажные карточки. В ситуации с использованием пылезащитной ленты на фаланги пальцев в первую очередь наносился специальный черный порошок, затем их прикладывали к липкой стороне ленты для фиксации отпечатков. После липкую сторону ленты, на которой были отображены фаланги, прикладывали к белым карточкам. В итоге полученные изображения были горизонтально обратными по сравнению с полученными при использовании чернильного рулона.
Для исследования выбраны пять пригодных пальцев рук мумифицированного трупа. Остальные пальцы исключены ввиду их серьезного разрушения и частичного отсутствия тканей. Перед процедурой все объекты были сморщенными, обладали темно-коричневой или черной окраской. Даже при увеличенном осмотре визуализировать борозды на фалангах было крайне затруднительно. Для восстановления применили 25%-ный раствор гидроксида аммония. Обработка выполнялась в течение 24 часов, после чего ткани пальца начали расширяться и размягчаться. Борозды на фалангах становились более заметными. Через 48 часов цвет фаланг стал светлым, а папиллярные линии отчетливые (рис. 2).
Рис. 2. Палец до и после обработки гидроксидом аммония. Перед регидратацией фаланга пальца была жесткой и сморщенной, темно-коричневого цвета (слева). После процедуры регидратации (48 часов) цвет пальца стал светлым, а линии отчетливыми (справа)105
Раствор карбоната натрия. Указательный палец левой руки поместили на дно контейнера с раствором карбоната натрия на 24 часа. По истечении указанного периода времени цвет раствора стал бледно-желтым, а сам он остался чистым. Через 48 часов с начала эксперимента цвет фаланги продолжил осветляться, а линии на поверхности пальца становились
...